题目内容
3.在下列反应中:A2(g)+B2(g)?2AB(g),△H<0,当其达到平衡时,在图的曲线中,符合勒沙特列原理的曲线是( )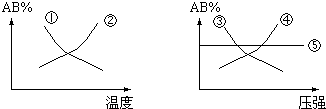
| A. | ①② | B. | ③④ | C. | ① | D. | ①⑤ |
分析 该反应正反应是放热反应,升高温度平衡向逆反应移动,AB%降低;该反应反应前后气体的体积不变,增大压强,平衡不移动,AB%不变,结合图象AB%与温度、压强变化选择.
解答 解:该反应正反应是放热反应,升高温度平衡向逆反应移动,AB%降低,由左图可知,曲线①符合变化;
该反应反应前后气体的体积不变,增大压强,平衡不移动,AB%不变,由右图可知,曲线⑤符合变化;
故选D.
点评 本题考查外界条件对化学平衡的影响、化学平衡图象等,比较基础,注意理解平衡移动原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.在天平两端的烧杯中,分别盛有足量等质量、等质量分数的稀硫酸,天平平衡后,往天平两端的烧杯中,分别加入等质量的镁和铜、铝合金,恰好完全反应,且天平仍保持平衡,则铜、铝合金中铜和铝的质量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
20. 常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
 常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)>c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
7.下列关于四个实验装置的说法中正确的是( )

| A. | 图一:引发铝热反应的操作是点燃镁条 | |
| B. | 图二:可用于化学反应速率的测定 | |
| C. | 图三:滴加K3[Fe(CN)6]溶液,产生特征蓝色沉淀 | |
| D. | 图四:酸式滴定管注入Na2CO3溶液之前应检查是否漏液 |
8.下列实验室除杂所用试剂和操作均合理的为( )
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 碳酸钡(硫酸钡) | 饱和碳酸钠溶液 | 搅拌、过滤 |
| B | CO2(HCl) | 饱和碳酸钠溶液 | 洗气 |
| C | FeCl3(FeCl2) | 足量铁粉 | 搅拌、过滤 |
| D | HCl(Cl2) | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
12.一定温度和压强下,在某固定容积的容器中,可逆反应2A(s)+B(g)?2C(g),已经达到平衡,欲提高B的转化率,可采取的措施是( )
| A. | 增加A物质的质量 | B. | 向容器中再充入B气体 | ||
| C. | 升高反应体系的温度 | D. | 从容器中移出部分C气体 |
13. 我国科学家屠呦呦因发现青蒿素治疗疟疾新疗法而获得2015年诺贝尔生理学或医学奖,已知青蒿素的结构简式如图.下列说法不正确的是( )
我国科学家屠呦呦因发现青蒿素治疗疟疾新疗法而获得2015年诺贝尔生理学或医学奖,已知青蒿素的结构简式如图.下列说法不正确的是( )
 我国科学家屠呦呦因发现青蒿素治疗疟疾新疗法而获得2015年诺贝尔生理学或医学奖,已知青蒿素的结构简式如图.下列说法不正确的是( )
我国科学家屠呦呦因发现青蒿素治疗疟疾新疗法而获得2015年诺贝尔生理学或医学奖,已知青蒿素的结构简式如图.下列说法不正确的是( )| A. | 青蒿素可能具有强氧化性,具有杀菌消毒作用 | |
| B. | 青蒿素难溶于水,能溶于NaOH溶液 | |
| C. | 青蒿素分子中含有碳氧双键,但不能发生加成反应 | |
| D. | 青蒿素与纤维素一样,都属于有机高分子化合物 |
 已知:
已知:
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).