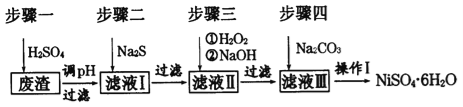
题目内容
【题目】在1×105 Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H-H键 | N三N键 | N-H键 |
键能(kJ·mol-1) | 436 | 945 | 391 |
工业合成氨的化学方程式:N2+3H2![]() 2NH3,
2NH3,
断开1 mol N2中的化学键需_____ (填“吸收”或“放出”)945 kJ能量,形成2 mol NH3中的化学键需_____ (填“吸收”或“放出”) ________ kJ能量;
在298 K时,取1 mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为____________ kJ。
根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应。
【答案】 吸收 放出 2346 93 放热
【解析】断开1 mol N2中的化学键需吸收945 kJ能量,形成2 mol NH3中的化学键需放出2×3×391kJ=2346 kJ能量,因此反应热=945kJ/mol+3×436kJ/mol-2346 kJ/mol=-93kJ/mol,则在298 K时,取1 mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应,理论上放出的热量为93kJ。

练习册系列答案
相关题目