题目内容
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过 量,并将溶液加热,产生的气体与HC1的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
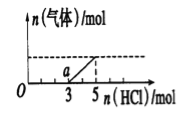
A.0点溶液中所含溶质的化学式为NaOH、Na2CO3
B.常温下,a点溶液pH>7
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5mol/L
【答案】C
【解析】
试题分析:A.Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,HCl与Na2CO3、NaHCO3都按1:1反应,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,则溶液中溶质为NaOH、Na2CO3,A项正确;B.常温下,a点的溶液为NaHCO3溶液,碳酸氢钠溶液显碱性,所以pH>7,B项正确;C.由图可知,a点时开始生成气体,发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗的HCl的物质的量为2mol,由方程式可知产生二氧化碳的物质的量为2mol,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,开始通入的二氧化碳的体积为2mol×22.4L/mol=44.8L,C项错误;D.加入5molHCl生成二氧化碳体积最大,此时溶液中溶质为NaCl,根据氯离子守恒有n(NaCl)=n(HCl),根据钠离子守恒有n(NaOH)=n(NaCl),n(NaOH)=n(HCl)=5mL,所以c(NaOH)=5mol÷2L=2.5mol/L,D项正确;答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】在1×105 Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H-H键 | N三N键 | N-H键 |
键能(kJ·mol-1) | 436 | 945 | 391 |
工业合成氨的化学方程式:N2+3H2![]() 2NH3,
2NH3,
断开1 mol N2中的化学键需_____ (填“吸收”或“放出”)945 kJ能量,形成2 mol NH3中的化学键需_____ (填“吸收”或“放出”) ________ kJ能量;
在298 K时,取1 mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为____________ kJ。
根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应。