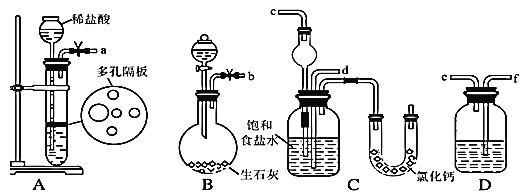
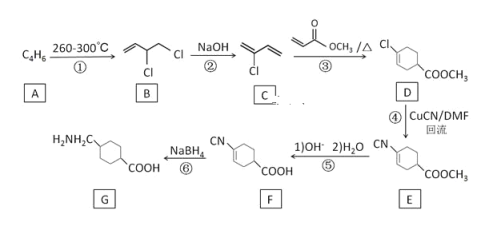
题目内容
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。则A的相对分子质量为:______。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为:________。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。用结构简式表示A中含有的官能团:______________________。
(4)A的核磁共振氢谱如下图:则A中含有__________种氢原子。
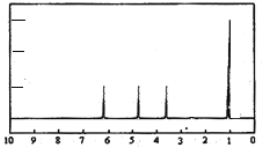
(5)综上所述,A的结构简式_______________________________。
【答案】90 C3H6O3 -COOH、-OH 4 ![]()
【解析】
(1)相同条件下,气体的相对分子质量之比等于密度之比;
(2)浓硫酸可以吸收水蒸气,碱石灰可以吸收二氧化碳气体,根据原子守恒计算分子中C、H原子数目,进而确定是否含有O元素,确定有机物的分子式;
(3)羧基可以和碳酸氢钠发生化学反应生成二氧化碳,-OH、-COOH和金属钠发生化学反应生成氢气,根据生成气体物质的量判断含有的官能团;
(4)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子;
(5)峰面积之比等于氢原子的数目之比,结合A的分子式、含有的官能团确定A的结构简式。
(1)该有机物A的密度是相同条件下H2的45倍,所以有机物A的相对分子质量=45×2=90,故答案为:90;
(2)9.0gA的物质的量=![]() =0.1mol,浓硫酸增重5.4g,则生成水的质量是5.4g,生成n(H2O)=
=0.1mol,浓硫酸增重5.4g,则生成水的质量是5.4g,生成n(H2O)=![]() =0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)=
=0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)=![]() =0.3mol,所以n(C)=0.3mol,n(A)∶n(C)∶n(H)=0.1mol∶0.3mol∶0.6mol=1∶3∶6,则有机物A中碳原子个数是3,氢原子个数是6,根据相对分子质量是90,所以氧原子个数=
=0.3mol,所以n(C)=0.3mol,n(A)∶n(C)∶n(H)=0.1mol∶0.3mol∶0.6mol=1∶3∶6,则有机物A中碳原子个数是3,氢原子个数是6,根据相对分子质量是90,所以氧原子个数=![]() =3,即分子式为:C3H6O3,故答案为:C3H6O3;
=3,即分子式为:C3H6O3,故答案为:C3H6O3;
(3)9.0gA的物质的量=![]() =0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)=
=0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)=![]() =0.1mol,所以含有一个羧基;醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),n(H2)=
=0.1mol,所以含有一个羧基;醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),n(H2)=![]() =0.1mol,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2∶1,A与钠反应时,A的物质的量与氢气的物质的量之比是1∶1,则说明A中除了含有一个羧基外还含有一个羟基,故答案为:-COOH、-OH;
=0.1mol,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2∶1,A与钠反应时,A的物质的量与氢气的物质的量之比是1∶1,则说明A中除了含有一个羧基外还含有一个羟基,故答案为:-COOH、-OH;
(4)根据A的核磁共振氢谱图可以看出,A的核磁共振氢谱中有4个峰值,则含4种类型的等效氢原子,故答案为:4;
(5)根据A的核磁共振氢谱可以看出,A的核磁共振氢谱中有4个峰值,且氢原子的个数比是3∶1∶1∶1,所以结构简式为:![]() ,故答案为:
,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g) ![]() H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g)
2NO(g) ![]() H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的![]() H>0,简述该设想能否实现的依据 。
H>0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
【题目】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。请补充完成该实验报告。
(1)(实验原理)
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察_____,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。
(2)(实验装置)如图1所示。

(实验过程与记录)
实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入25mL1molL﹣1的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加1molL﹣1的H2SO4溶液直至过量,边滴边振荡。 | (2)_____(填写支持实验结论的证据) | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(3)整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)可近似地用图2中的_____(填序号)曲线表示。
(4)下列三种情况下,与上述实验中离子方程式相同的是_____。
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为_____。