题目内容
16.在NaClO中加入浓盐酸产生黄绿色气体X,在Na2SO3中加入稀H2SO4产生无色气体Y,下列对X、Y的叙述中错误的是( )| A. | 将X、Y分别通入品红溶液中,均使品红溶液褪色 | |
| B. | 将X、Y分别通入氢硫酸中,只有Y能产生沉淀 | |
| C. | 等物质的量的X、Y同时通入品红溶液中,品红溶液不褪色 | |
| D. | 等物质的量的X、Y同时通入BaCl2溶液中,有沉淀产生 |
分析 在NaClO中加入浓盐酸产生黄绿色气体X,X为Cl2;在Na2SO3中加入稀H2SO4产生无色气体Y,二者反应生成SO2,所以Y为SO2;
A.氯气和水反应生成的次氯酸具有漂白性,二氧化硫能和有色物质反应生成无色物质而具有漂白性;
B.氯气能和硫化氢发生氧化还原反应生成S单质;
C.等物质的量的氯气、二氧化硫和水反应生成HCl和硫酸,盐酸和硫酸没有漂白性;
D.等物质的量的氯气、二氧化硫和水反应生成HCl和硫酸,硫酸和氯化钡反应生成硫酸钡白色沉淀.
解答 解:在NaClO中加入浓盐酸产生黄绿色气体X,X为Cl2;在Na2SO3中加入稀H2SO4产生无色气体Y,二者反应生成SO2,所以Y为SO2;
A.氯气和水反应生成的次氯酸具有漂白性,二氧化硫能和有色物质反应生成无色物质而具有漂白性,所以将X、Y分别通入品红溶液中,均使品红溶液褪色,故A正确;
B.氯气、二氧化硫和氢硫酸发生的反应为Cl2+H2S=S↓+2HCl、SO2+2H2S=3S↓+2H2O,所以都有沉淀生成,故B错误;
C.等物质的量的氯气、二氧化硫和水反应生成HCl和硫酸,发生的反应为Cl2+SO2+2H2O=2HCl+H2SO4,盐酸和硫酸没有漂白性,所以等物质的量的X、Y同时通入品红溶液中,品红溶液不褪色,故C正确;
D.等物质的量的氯气、二氧化硫和水反应生成HCl和硫酸,发生的反应为Cl2+SO2+2H2O=2HCl+H2SO4,硫酸和氯化钡反应生成硫酸钡白色沉淀,所以等物质的量的X、Y同时通入BaCl2溶液中,有沉淀产生,故D正确;
故选B.
点评 本题考查二氧化硫、氯气性质,为高频考点,涉及次氯酸、二氧化硫漂白性及氯气和二氧化硫及与水之间发生的反应,明确物质性质是解本题关键,注意次氯酸、二氧化硫漂白性区别,为易错点.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案| A. | 标准状况下,22.4LCH4中含有原子数目约为NA | |
| B. | 标准状况下,NA个H2O分子的体积约为22.4L | |
| C. | 常温常压下,NA个D2O分子的质量约为20g | |
| D. | 1L 0.5mol/L AlCl3溶液中含有的Al3+数目约为NA |
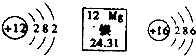
| A. | 镁属于金属元素 | |
| B. | 镁离子核内有12个质子 | |
| C. | 镁离子与硫离子的电子层数相等 | |
| D. | 在化学反应中,1个硫原子容易得到2个电子 |
 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是NH4++OH-=NH3+H2O.
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:

①X、Y与水混合后反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓.
②N→⑦的单质反应的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
③若将Y溶液加热蒸干、灼烧后得到的物质的化学式是Al2O3.
| A. | 葡萄糖、氨基酸在一定条件下都能发生酯化反应 | |
| B. |  的分子式为C17H26O3 的分子式为C17H26O3 | |
| C. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧时消耗氧气的量相等 | |
| D. | 结构片段为 的高聚物,是其单体通过缩聚反应生成的 的高聚物,是其单体通过缩聚反应生成的 |
| A. | 苯使溴水层褪色属于加成反应 | |
| B. | 乙烯与水反应生成乙醇属于水解反应 | |
| C. | 同二甲苯只有一种结构说明苯分子中不存在单双链交替 | |
| D. | 等质量环丁烷(C4H8)和乙烯(C2H4)完全燃烧,消耗的氧气量相等 |
| A. | Na2CO3溶液中c(Na+)与c(CO32-)之比大于2:1 | |
| B. | 蒸发氯化铝溶液要不断通入氯化氢气体方可得到氯化铝晶体 | |
| C. | 1 L 0.3 mol/L醋酸溶液中H+个数与3 L 0.1 mol/L醋酸溶液中H+个数之比为1:1 | |
| D. | 浓度相同的下列溶液中,按pH由小到大的顺序排列的是CH3COONa、NaHCO3、Na2CO3 |
 NO2+3H2$\stackrel{140℃}{→}$
NO2+3H2$\stackrel{140℃}{→}$
 +4MnO2+5H2SO4→2
+4MnO2+5H2SO4→2 +4MnSO4+1(NH4)2SO4+4H2O.
+4MnSO4+1(NH4)2SO4+4H2O.