题目内容
【题目】(化学——选修2:化学与技术)
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:
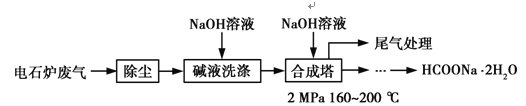
(1)上述工艺用碱液洗涤的目的是___________,可能发生的反应有______________(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________;最后尾气主要成分是__________________。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________。
【答案】除去其中的CO2、H2S等酸性气体 CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O 使尾气中的CO被充分吸收 N2和CH4 2HCOONa![]() Na2C2O4+H2↑ HCOO-+2SO2+OH-=S2O42-+CO2+H2O 4.12×104L
Na2C2O4+H2↑ HCOO-+2SO2+OH-=S2O42-+CO2+H2O 4.12×104L
【解析】
电石炉废气先除尘,然后用碱液洗涤,溶液中的二氧化碳和硫化氢反应生成盐,然后将气体通入合成塔,并加入氢氧化钠溶液,加热至160-200度,加压,最终得到甲酸钠晶体,最后剩余氮气和甲烷,将尾气排空。
试题(1)碱液具有碱性,能吸收酸性气体,二氧化硫和硫化氢都是酸性气气体,被碱液吸收,所以作用为除去其中的CO2、H2S等酸性气体,反应方程式为:CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O。
(2)反应物接触面积越大,反应越充分,合成工艺中采用循环喷射吸收合成目的是增大反应物接触面积,使尾气中的CO被充分吸收,反应过程中N2和CH4不参加反应,所以最后排空的尾气主要成分是氮气和甲烷。
(3)甲酸钠高温分解生成草酸钠和氢气,方程式为2HCOONa![]() Na2C2O4+H2↑。
Na2C2O4+H2↑。
(4)反应物是甲酸钠,氢氧化钠和二氧化硫,生成物是Na2S2O4和二氧化碳和水,离子方程式为:HCOO-+2SO2+OH-=S2O42-+CO2+H2O。
(5)5%的甲酸钠溶液1吨,含有甲酸钠的物质的量为1000000×5%/68=735.3摩尔,根据碳元素守恒,甲酸钠生成产率为40%,则需要一氧化碳的物质的量为735.3/40%=1838.3摩尔,一氧化碳的体积为1838.3×22.4=4.12×104L。

【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
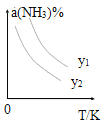
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的/span>NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
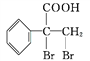
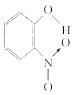
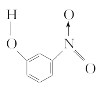
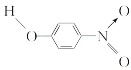
【题目】已知各种硝基苯酚的性质如下表:
名称 | 结构式 | 溶解度/(g/100 g水,25 ℃) | 熔点 /℃ | 沸点 /℃ |
邻硝基苯酚 |
| 0.2 | 45 | 100 |
间硝基苯酚 |
| 1.4 | 96 | 194 |
对硝基苯酚 |
| 1.7 | 114 | 295 |
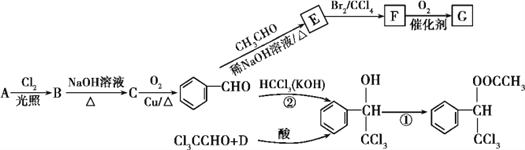
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔沸点低于另两种硝基苯酚
B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小