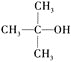
��Ŀ����
����Ŀ����ij�¶ȣ�T�棩��ˮ��Һ�У�c(H+)��10xmol/L��c(OH��)��10ymol/L��x��y��ϵ��ͼ��ʾ��
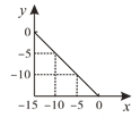
��1�����¶��£�ˮ�����ӻ�Ϊ________��T��_____25�棨������������С������������������
��2�������¶���pH��11��NaOH��Һ��pH��1��HCl��Һ�������ϣ���Ϻ���Һ��pHԼΪ________������֪lg2��0.3��
��3���ڴ��¶��£���pH��13��NaOH��ҺVaL��pH��1��������ҺVbL��ϡ������û��Һ��pH��2����Va:Vb ��_______��
���𰸡�10-15 С�� 1.3 9:2
��������
�Ÿ���������������x ��y�ó�ˮ�����ӻ���
��������¶���pH��11��NaOH��Һc(OH��)��pH��1��HCl��Һc(H+)���ټ����Ϻ���Һ��������Ũ�Ⱥ�pH��
���г��ڴ��¶��£���pH��13��NaOH��ҺVa L��c(OH��)��pH��1��������ҺVb L��c(H+)���������⽨����ϵʽ�õ�Va��Vb��
��Ѱ������һ��õ�x ��5ʱ��y�� 10����˸��¶��£�ˮ�����ӻ�Ϊ![]() ��
��![]() ���¶�Խ�ͣ����ӻ�����ԽС�����T ��С��25 �����ʴ�Ϊ��1015��С�ڡ�
���¶�Խ�ͣ����ӻ�����ԽС�����T ��С��25 �����ʴ�Ϊ��1015��С�ڡ�
�ƴ��¶���pH��11��NaOH��Һc(OH��)��1��104molL1��pH��1��HCl��Һc(H+)��1��101molL1�������ߵ������ϣ�![]() ����Ϻ���Һ��pHԼΪpH��2lg5 ��20.7��1.3���ʴ�Ϊ��1.3��
����Ϻ���Һ��pHԼΪpH��2lg5 ��20.7��1.3���ʴ�Ϊ��1.3��
���ڴ��¶��£�pH��13��NaOH��ҺVa L��c(OH��)��1��102molL1��pH��1��������ҺVb L��c(H+)��1��101molL1������������û��Һ��pH��2��![]() ����Va��Vb ��9:2���ʴ�Ϊ��9��2��
����Va��Vb ��9:2���ʴ�Ϊ��9��2��

����Ŀ������̼��ˮ�����Ʊ�ˮú���ĺ��ķ�ӦΪ��C(s)��H2O(g)H2(g)��CO(g)
(1)��֪̼(ʯī)��H2��CO��ȼ���ȷֱ�Ϊ393.5kJ��mol��1��285.8kJ��mol��1��283kJ��mol��1����֪H2O(l)=H2O(g)����H����44kJ��mol��1����C(s)��H2O(g)CO(g)��H2(g)����H��___��
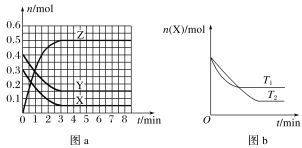
(2)��ij�¶��£������Ϊ1L�ĺ����ܱո��������м�����������̿��������1mol H2O(g)����������Ӧ����Ӧʱ����������������ѹǿ�����������
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
��ѹǿ/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
��ƽ��ʱ�����������������ʵ���Ϊ________mol��H2O��ת����Ϊ________��
�����¶��·�Ӧ��ƽ���ѹ����Kp��________kPa(�������2λ��Ч����)��
(3)����25��������㶨��1L������Ͷ����������̿��������壬�������淴ӦC��H2O(g)CO��H2���ѽ���ƽ�⣬��40 minʱ�ٳ���һ����H2��50minʱ�ٴδﵽƽ�⣬��Ӧ�����и����ʵ�Ũ����ʱ��仯��ͼ��ʾ��
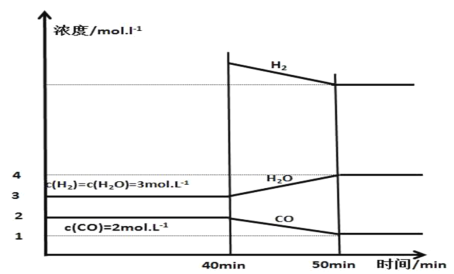
��40minʱ���ٳ����H2�����ʵ���Ϊ________mol��
��40��50 min��H2��ƽ����Ӧ����Ϊ________mol��L��1��min��1��
(4)���͵������������ڽ����ơ�������Ͷ�����(Na2Sx)�ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մ�(�ɴ���Na��)Ϊ����ʣ���ԭ����ͼ��ʾ��
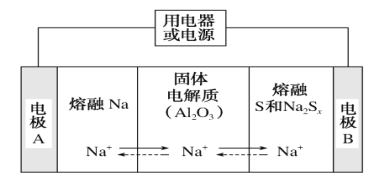
���ŵ�ʱ���缫AΪ________����S����________��Ӧ�����������ԭ������
�����ʱ���ܷ�ӦΪNa2Sx=2Na��Sx(3<x<5)��Na���ڵ缫��ֱ����Դ________�������������ĵ缫��ӦʽΪ_________��