题目内容
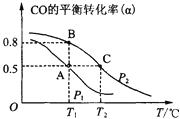
【题目】利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
(1)写出该反应的平衡常数表达式为__________________.
(2)上述合成甲醇的反应为________反应(填“放热”或“吸热”). A、B、C三点的平衡常数KA、KB、KC的大小关系为____________.A、B两点对应的压强大小关系是PA________PB(填“大于”、“小于”或“等于”).
(3)若反应达到平衡状态A时,保持容器体积及体系温度不变,再向容器中充入2mol CO(g)、4molH2(g)、 2molCH3OH(g)则平衡向______方向移动(填“正”或“逆”)
(4)通常状况下取一定量的甲醇充分完全燃烧生成27克的水,放出热量544.35KJ,请写出表示甲醇燃烧热的热化学反应方程式_______________________________________。
【答案】c(CH3OH)/[c(CO)×c2(H2)]放热KA=KB>KC小于正CH3OH(l)+2O2(g)=CO2(g)+2H2O(l) ΔH= -725.8 kJ·mol-1
【解析】
(1)根据化学平衡常数的定义,该反应的平衡常数为![]() ;
;
(2)根据图像,随着温度的升高,CO的平衡转化率降低,根据勒夏特列原理,该反应为放热反应;化学平衡常数只受温度的影响,A和B温度相同,化学平衡常数相等,即KA=KB,C的温度高于A和B,该反应为放热反应,升高温度,平衡逆向进行,化学平衡常数减小,即KA=KB>KC;根据勒夏特列原理,增大压强,平衡正向移动,CO的转化率增大,B点CO的转化率大于A点,即PA<PB;
(3)CO(g)+2H2(g)CH3OH(g)
起始:10 20 0
变化:5 10 5
平衡:5 10 5 令此时容器的体积为1L,平衡常数K=5/(5×102)=1/100,再通入2molCO、4molH2、2molCH3OH,此时容器内的CO的物质的量为7mol、H2的物质的量为14mol、CH3OH的物质的量为7mol,浓度商为1/142<1/100,说明反应向正反应方向进行;
(4)甲醇与O2反应的方程式为CH3OH+2O2=CO2+2H2O,生成36gH2O时放出的热量为36×544.35/27kJ=725.8kJ,即热化学反应方程式为CH3OH(l)+2O2(g)=CO2(g)+2H2O(l) ΔH= -725.8 kJ·mol-1。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】(Ⅰ)在体积为2L的密闭容器中,某可逆反应(ABC均为气体),从0~2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示。

(1)则该反应的反应物是________,生成物是_______;
(2)该反应的化学方程式为__________;
(3)反应开始至2分钟时,用C表示反应速率________;
(4)2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了______状态。
(Ⅱ)对于反应:2SO2(g)+O2(g)![]() 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)。
编 号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 | _______ |
② | 降低温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 使用V2O5作催化剂 | ______ |