题目内容
【题目】将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法中正确的是__(填序号).

A.甲、乙均为化学能转变为电能的装置
B.甲中铜为正极,乙中铜为负极
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中的pH值均增大
(2)在相同时间内,两烧杯中产生气泡的速率:甲__乙(填“>”、“<”或“=”).
(3)写出甲池中负极反应的电极反应式为:_______________________________。
(4)当甲中产生3.36L(标准状况)气体时,理论上通过导线的电子数目为____________。
【答案】D > Zn-2e-=Zn2+ 0.3NA(或1.806×1023)
【解析】
(1)甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌与溶液中的氢离子发生氧化还原反应,锌电极上冒气泡,据此分析作答;
(2)作原电池负极的金属,反应速率比普通化学反应快;
(3)负极锌失电子发生还原反应;
(4)根据氢气和转移电子之间的关系式计算;
(1)A. 甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,A项错误;
B. 乙不能构成原电池,氢离子在锌片上得电子发生还原反应,铜不能作正极,B项错误;
C. 甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,C项错误;
D. 两烧杯总反应均为锌和氢离子发生的置换反应,最终导致溶液中氢离子浓度减小,所以溶液的pH均增大,D项正确;
故答案为D;
(2)甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙;
(3)甲池中负极发生锌失电子的氧化反应,其电极反应式为:Zn-2e-=Zn2+;
(4)甲中,铜电极上氢离子得电子生成氢气,若产生的3.36 L氢气在标准状况下的物质的量=![]() =0.15mol,根据电极反应式为2H++2e-=H2↑可知,理论上通过导线的电子数目为0.15×2×NA=0.3NA(或1.806×1023)。
=0.15mol,根据电极反应式为2H++2e-=H2↑可知,理论上通过导线的电子数目为0.15×2×NA=0.3NA(或1.806×1023)。

 互动英语系列答案
互动英语系列答案【题目】I. 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为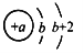 。
。
W | X | Y |
Z |
请回答下列问题:
(1)Z元素在元素周期表中的位置是__________________________________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序为_________(元素符号表示)。
(3)X、Z、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序为________(用化学式表示)。
(4)用电子式表示WY2的形成过程__________________________________。
(5)写出W单质与浓硫酸反应的化学方程式_____________________________。
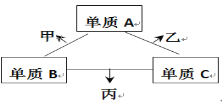
Ⅱ. A、B、C三种物质存在如图转化关系。
![]()
(6)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________。
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
ⅠA | 0 | ||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | B | ① | ② | Ne | |||||
3 | ③ | ④ | ⑤ | Si | ⑥ | ⑦ | |||
(1) ①的元素符号是__________
(2) ②和⑥两种元素的原子半径大小关系:_________(填“>”或“<”);
(3) ③和⑤两种元素的金属性强弱关系:________(填“>”或“<”);
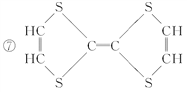
(4)③和⑦形成的化合物属于_________(填“离子化合物”或“共价化合物”);写出该化合物的电子式为:______________________;
(5)写出元素②在周期表中的位置_______________________;
(6)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:_____________。