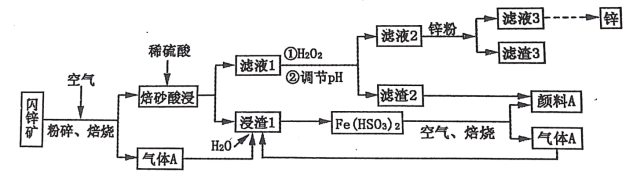
题目内容
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) ![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) ![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) ![]() 2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
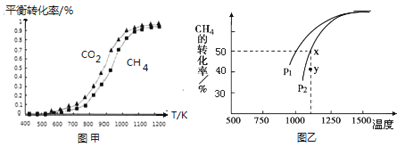
同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
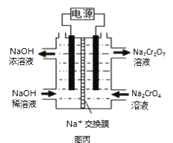
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
III.根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
【答案】第二步  大于 大于
大于 大于 ![]() 正 4Na2CrO4+4H2O
正 4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑ (2﹣
2Na2Cr2O7+4NaOH+2H2↑+O2↑ (2﹣![]() )×100% CH3OH﹣6e﹣+3CO32﹣=4CO2+2H2O
)×100% CH3OH﹣6e﹣+3CO32﹣=4CO2+2H2O
【解析】
I.①已知总反应的快慢由慢的一步决定,
②由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,而正反应是放热反应,所以升高温度,平衡常数减小;
II.(1)根据图示可以看出,CO2发生了其他副反应;
(2)①反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)是个气体体积增大的反应,根据压强对化学平衡的影响作答;
2CO(g)+2H2(g)是个气体体积增大的反应,根据压强对化学平衡的影响作答;
②CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),利用三段式计算平衡时各组分物质的量,利用压强之比等于物质的量之比计算平衡时总压强,再计算各组分分压,根据Kp=
2CO(g)+2H2(g),利用三段式计算平衡时各组分物质的量,利用压强之比等于物质的量之比计算平衡时总压强,再计算各组分分压,根据Kp=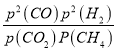 计算;
计算;
III.右侧电极生成H+,则消耗OH-,发生氧化反应,右侧为阳极,则左侧为阴极,连接电源的负极;
根据反应方程式计算;
甲醇(CH3OH)在负极发生氧化反应。
I.①第二步:N2O2(g)+O2(g)═2NO2(g) (慢),主要是由第二步决定反应速率,
故答案为:第二步;
②由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=![]() =
= ;
;
故答案为: ;
;
II.(1)根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率,
故答案为:大于;
(2)①反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)是个气体体积增大的反应,压强越大,CH4的转化率越小,由图可知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)>v(逆),
2CO(g)+2H2(g)是个气体体积增大的反应,压强越大,CH4的转化率越小,由图可知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)>v(逆),
故答案为:大于;
②由图知道该温度下X所处件下平衡时甲烷的转化率为50%,列三段式:
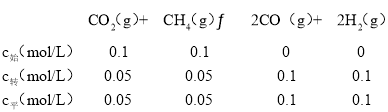
总物质的量=0.3mol,0.3总压为P2,其平衡常数Kp=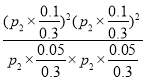 =
=![]() ;
;
故答案为:![]() ;
;
III.根据2CrO42-+2H+=Cr2O72-+H2O电解Na2CrO4溶液制取Na2Cr2O7,应在酸性条件下进行,即右侧电极生成H+,则消耗OH-,发生氧化反应,右侧为阳极,则左侧为阴极,连接电源的负极,电解制备过程的总反应方程式为 4Na2CrO4+4H2O ![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑,设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x)mol,n(Cr)=(1-x)mol,生成的Na2Cr2O7为
2Na2Cr2O7+4NaOH+2H2↑+O2↑,设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x)mol,n(Cr)=(1-x)mol,生成的Na2Cr2O7为![]() mol,对应的n(Na)=xmol,n(Cr)=xmol,根据:Na与Cr的物质的量之比为a:b,解得x=2-
mol,对应的n(Na)=xmol,n(Cr)=xmol,根据:Na与Cr的物质的量之比为a:b,解得x=2-![]() ,转化率为
,转化率为 =(2-
=(2-![]() )×100%,
)×100%,
若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,
故答案为:负; 4Na2CrO4+4H2O ![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2-
2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2-![]() )×100%;CH3OH-6e-+3CO32-=4CO2+2H2O。
)×100%;CH3OH-6e-+3CO32-=4CO2+2H2O。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】弱酸HA的电离常数![]() 。25℃时,有关弱酸的电离常数如下:
。25℃时,有关弱酸的电离常数如下:
弱酸化学式 | HCOOH | ②CH3COOH | C6H5OH | ④H2A |
电离常数 | 1.810-4 | 1.810-5 | 1.310-10 | K1=4.310-7,K2=5.610-11 |
⑴四种酸的酸性由强到弱的顺序是________________(用序号填空)。
⑵向0.1 mol/L CH3COOH溶液中滴加NaOH至溶液中![]() 时,此时溶液的pH=________。
时,此时溶液的pH=________。
⑶当H2A与NaOH溶液1:1混合溶液显________性(选填“酸、中、碱”)。