题目内容
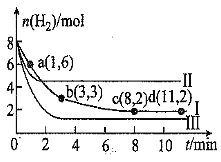
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mo B,发生反应:2A(g)+B(g)![]() 2D(g) △H=Q kJ/mol,相关条件和数据见下表:下列说法正确的是( )
2D(g) △H=Q kJ/mol,相关条件和数据见下表:下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
A.Q<0,K3>K2>K1
B.实验I和Ⅱ探究的是催化剂对于化学反应的影响
C.实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡向正向移动
D.A的转化率:Ⅲ![]() Ⅱ
Ⅱ![]()
【答案】B
【解析】
A.反应为2A(g)+B(g)![]() 2D(g),比较实验I和III,温度升高,平衡时D的量减少,化学平衡向逆反应方向移动,温度相同,平衡常数相同,据此分析;
2D(g),比较实验I和III,温度升高,平衡时D的量减少,化学平衡向逆反应方向移动,温度相同,平衡常数相同,据此分析;
B.实验II达到平衡的时间很短,与实验I温度相同,平衡时各组分的量也相同,据此判断;
C.温度不变,平衡常数不发生改变,根据浓度商与平衡常数K的关系判断化学反应的方向;
D.图表数据分析,实验I和Ⅱ探究的是催化剂对于化学反应的影响,A转化率不变,实验III中温度升高平衡逆向进行。
A.反应为2A(g)+B(g)![]() 2D(g),比较实验I和III,温度升高,平衡时D的量减少,说明化学平衡向逆反应方向移动,由于该反应的正反应为放热反应,Q<0,则K3<K1,温度相同,平衡常数相同,则K1=K2,综上,则平衡常数的关系为:K3<K2=K1,A错误;
2D(g),比较实验I和III,温度升高,平衡时D的量减少,说明化学平衡向逆反应方向移动,由于该反应的正反应为放热反应,Q<0,则K3<K1,温度相同,平衡常数相同,则K1=K2,综上,则平衡常数的关系为:K3<K2=K1,A错误;
B.实验II达到平衡的时间很短,与实验I温度相同,平衡时各组分的量也相同,可判断实验II使用了催化剂,催化剂加快反应速率,但不改变化学平衡状态,实验I和Ⅱ探究的是催化剂对于化学反应的影响,B正确;
C.实验III中,原平衡的化学平衡常数为K=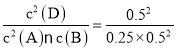 =4,温度不变,则平衡常数不变,实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,则此时容器中c(A)=1 mol/L,c(B)=0.25 mol/L,c(D)= 1mol/L,此时浓度商Q=
=4,温度不变,则平衡常数不变,实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,则此时容器中c(A)=1 mol/L,c(B)=0.25 mol/L,c(D)= 1mol/L,此时浓度商Q=![]() =4,则平衡不发生移动,C错误;
=4,则平衡不发生移动,C错误;
D.图表数据分析,实验I和Ⅱ探究的是催化剂对于化学反应的影响,A转化率不变,实验III中温度升高平衡逆向进行,A的转化率减小,A的转化率:Ⅲ<Ⅱ=I,D错误;
故合理选项是B。

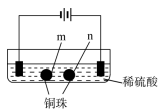
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜