题目内容
【题目】下列溶液中各种微粒浓度大小关系或结论正确的是( )
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: ![]()
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(H+)=2c(OH-)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
【答案】A
【解析】
A. 二者反应后溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)+c(NH4+)=2c(SO42-)+c(OH),所以得c(Na+)+c(NH4+)=2c(SO42-),要使溶液呈中性,则氢氧化钠稍微过量,所以c(Na+)>c(SO42-),水的电离较微弱,所以溶液中这几种离子浓度大小顺序是![]() ,故A正确;
,故A正确;
B.pH相等的盐溶液和强碱溶液中,强碱的浓度最小,酸根离子水解程度越大其相同pH的钠盐浓度越小,醋酸根离子水解程度小于碳酸根离子,所以pH相等的这几种溶液中,浓度大小顺序是c(NaOH)<c(Na2CO3)<c(CH3COONa),故B错误;
C.根据电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),根据物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),两式消去钠离子浓度可得到c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故C错误;
D.0.1mol/L-1的NaHA溶液,其pH=4,则HA-的电离程度大于水解程度,则c(A2-)>c(H2A),故D错误;
故选:A。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。
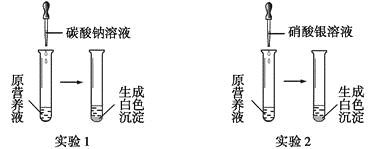
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是__________(填化学式),写出生成白色沉淀的离子方程式是________________________。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由____种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,则所用硝酸钾和氯化钙的物质的量之比是__________。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 68.4 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
①“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
②配制该500mL “鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有________。
③在溶液配制过程中,下列操作能使配制结果偏小的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.移液时,液体不小心从外壁流出
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mo B,发生反应:2A(g)+B(g)![]() 2D(g) △H=Q kJ/mol,相关条件和数据见下表:下列说法正确的是( )
2D(g) △H=Q kJ/mol,相关条件和数据见下表:下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
A.Q<0,K3>K2>K1
B.实验I和Ⅱ探究的是催化剂对于化学反应的影响
C.实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡向正向移动
D.A的转化率:Ⅲ![]() Ⅱ
Ⅱ![]()
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060


