题目内容
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是( )
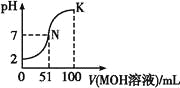
A.HA可能为一元弱酸
B.MOH为一元强碱
C.N点水的电离程度小于K点水的电离程度
D.若K点对应的溶液的pH=10,则有c(MOH)+c(M+)=0.01 mol·L-1
【答案】D
【解析】
A.由图可知,常温下0.01 mol·L-1HA溶液pH=2,则说明HA为一元强酸,A错误;
B.向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液50 mL时,两者恰好反应生成盐,但溶液pH<7,溶液显酸性,故MOH为一元弱碱,B错误;
C.溶液中的MOH在K点比N点多了49 mLMOH,c(OH-)大,抑制了水的电离,故N点水的电离程度大于K点,C错误;
D.K点溶液的体积为200 mL,根据物料守恒,c(MOH)+c(M+)=![]() =0.01 mol·L-1,D正确。
=0.01 mol·L-1,D正确。
故选D。

练习册系列答案
相关题目
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mo B,发生反应:2A(g)+B(g)![]() 2D(g) △H=Q kJ/mol,相关条件和数据见下表:下列说法正确的是( )
2D(g) △H=Q kJ/mol,相关条件和数据见下表:下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
A.Q<0,K3>K2>K1
B.实验I和Ⅱ探究的是催化剂对于化学反应的影响
C.实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡向正向移动
D.A的转化率:Ⅲ![]() Ⅱ
Ⅱ![]()