题目内容
下表是元素周期表的一部分,回答下列有关问题:
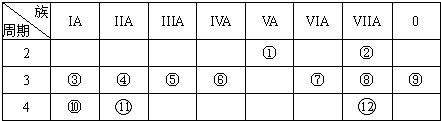
(1)写出下列元素符号:①
(2)画出原子的结构示意图:④
 ,⑤
,⑤
 ,⑧
,⑧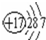
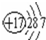 .
.
(3)在这些元素中,最活泼的金属元素是
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是
(5)在③与④中,化学性质较活泼的是
在⑧与中,化学性质较活泼的是

(1)写出下列元素符号:①
N
N
,⑥Si
Si
,⑦S
S
.(2)画出原子的结构示意图:④




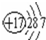
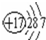
(3)在这些元素中,最活泼的金属元素是
K
K
,最活泼的非金属元素是F
F
,最不活泼的元素是Ar
Ar
.(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是
HClO4
HClO4
,碱性最强的是KOH
KOH
,呈两性的氢氧化物是Al(OH)3
Al(OH)3
.(5)在③与④中,化学性质较活泼的是
Na
Na
,怎样用化学实验证明:答:与H2O反应
与H2O反应
在⑧与中,化学性质较活泼的是
Cl2
Cl2
,怎样用化学实验证明?答:Cl2+2NaBr=2NaCl+Br2
Cl2+2NaBr=2NaCl+Br2
.分析:(1)根据元素周期表的结构分析.
(2)根据电子层数和最外层电子数以及核外电子排布规律思考.
(3)根据元素金属性和非金属的递变规律解答.
(4)根据元素最高价氧化物对应水化物的递变规律或元素的金属性、非金属性的递变规律思考.
(5)根据元素金属性强弱和非金属性强弱的判断方法思考.
(2)根据电子层数和最外层电子数以及核外电子排布规律思考.
(3)根据元素金属性和非金属的递变规律解答.
(4)根据元素最高价氧化物对应水化物的递变规律或元素的金属性、非金属性的递变规律思考.
(5)根据元素金属性强弱和非金属性强弱的判断方法思考.
解答:解:(1)根据元素周期表的结构可知:①、⑥、⑦分别在第二周期VA、第三周期IIA和第三周期VIA,则①、⑥、⑦分别为C、Si、S.
(2)根据元素周期表可判断,④、⑤、⑧分别是Mg、Al和Cl,Mg、Al和Cl均有3个电子层,最外层电子数分别为2、3、7,根据核外电子排布规律,Mg、Al和Cl的原子结构示意图分别为 ;
; ;
;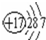 .
.
(3)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na(③)和K(⑩)中K最活泼;在VII元素Cl(⑧)和Br中,Cl最活泼;最不活泼的是⑨即Ar.
(4)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性增强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是②即F,但F无最高正价.因为我们知道,HClO4已知的最高价含氧酸中酸性最强的,即酸性最强的是HClO4.
元素的最高价氧化物对应水化物中,碱性最强的必是非金属性增强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑩即K,则碱性最强的必是KOH.
在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性.
(5)③和④分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,即:与H2O反应.
⑧和 11分别是Cl和Br,根据同主族元素非金属性的递变规律可知,非金属性Cl>Br,根据判断非金属性强弱的方法,可依据二者气态氢化物的稳定性、单质之间的置换反应等来判断其非金属性强弱,即Cl2+2NaBr=2NaCl+Br2.
故答案为:
(1)①N;⑥Si;⑦S;
(2) ;
; ;
;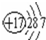
(3)K;F;Ar
(4)HClO4;KOH;Al(OH)3;
(5)Na;与H2O反应;Cl2;Cl2+2NaBr=2NaCl+Br2
(2)根据元素周期表可判断,④、⑤、⑧分别是Mg、Al和Cl,Mg、Al和Cl均有3个电子层,最外层电子数分别为2、3、7,根据核外电子排布规律,Mg、Al和Cl的原子结构示意图分别为
 ;
; ;
;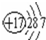 .
.(3)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na(③)和K(⑩)中K最活泼;在VII元素Cl(⑧)和Br中,Cl最活泼;最不活泼的是⑨即Ar.
(4)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性增强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是②即F,但F无最高正价.因为我们知道,HClO4已知的最高价含氧酸中酸性最强的,即酸性最强的是HClO4.
元素的最高价氧化物对应水化物中,碱性最强的必是非金属性增强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑩即K,则碱性最强的必是KOH.
在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性.
(5)③和④分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,即:与H2O反应.
⑧和 11分别是Cl和Br,根据同主族元素非金属性的递变规律可知,非金属性Cl>Br,根据判断非金属性强弱的方法,可依据二者气态氢化物的稳定性、单质之间的置换反应等来判断其非金属性强弱,即Cl2+2NaBr=2NaCl+Br2.
故答案为:
(1)①N;⑥Si;⑦S;
(2)
 ;
; ;
;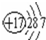
(3)K;F;Ar
(4)HClO4;KOH;Al(OH)3;
(5)Na;与H2O反应;Cl2;Cl2+2NaBr=2NaCl+Br2
点评:本题综合性较强,涵盖了元素周期表、元素性质的递变规律、元素金属性及非金属性强弱的判断方法等,要求用多方面的知识解决问题,能很好滴训练综合运用知识解决问题的能力.

练习册系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是