题目内容
14.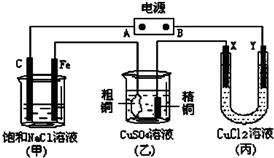 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题:(1)在电源中,B电极为负极(填电极名称,下同);丙装置中Y电极为阴极.
(2)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为0.224L.
分析 (1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,据此确定其他电极名称;
(2)根据串联电路中转移电子是相等的电子守恒规律来计算即可.
解答 解:(1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,A是正极、B是负极,X是阳极,Y是阴极,
故答案为:负;阴;
(2)乙装置中精铜电极的质量增加了0.64g,根据电极反应:Cu2++2e-=Cu,即生成0.64g即0.01mol铜,转移电子是0.02mol,铁电极是阴极,该极上产生氢气,2H++2e-=H2↑,当转移0.02mol电子时,该极上产生的气体为0.01mol,在标准状况下体积为0.224L,故答案为:0.224.
点评 本题以电解池原理为载体考查了正负极的判断、电极反应式的书写等知识点,难度中等,明确溶液中离子的放电顺序是解本题的关键.

练习册系列答案
相关题目
4.下列化学用语正确的是( )
| A. | 醛基的结构简式-COH | B. | 丙烯分子的结构简式为:CH3CHCH2 | ||
| C. | 四氯化碳分子的电子式为: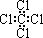 | D. | 2-乙基-1,3-丁二烯的键线式: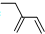 |
5.下列化合物中只存在离子键的是( )
| A. | NH3 | B. | CaCl2 | C. | H2SO4 | D. | Na2O2 |
9.N2+3H2$\frac{\underline{\;一定条件\;}}{\;}$2NH3,是工业上制造氮肥的重要反应.下列关于该反应的说法正确的是( )
| A. | 增加N2的浓度能加快反应速率 | |
| B. | 降低体系温度能加快反应速率 | |
| C. | 使用催化剂不影响反应速率 | |
| D. | 若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
19.${\;}_{6}^{13}$C-NMR(核磁共振)可以用于含碳化合物的结构分析,${\;}_{6}^{13}$C表示的碳原子( )
| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数为13,原子序数为6,核内有7个质子 | |
| D. | 质量数为13,原子序数为6,核内有7个中子 |
6.已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ•mol-1
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
| A. | 正丁烷分子储存的能量大于异丁烷分子 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
3.下列反应中,不属于加成反应的是( )
| A. | 乙炔与氯化氢反应制取氯乙烯 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 乙醛与氢气反应生成乙醇 | D. | 苯与液溴在铁催化作用下反应 |
4.下列有关实验现象的描述不正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 用铜板做电极电解硫酸铜溶液,阴极铜板质量增加 | |
| C. | 把铜片插入氯化铁溶液中,加入几滴氯化铜溶液,气泡放出的速率加大 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出的速率加大 |
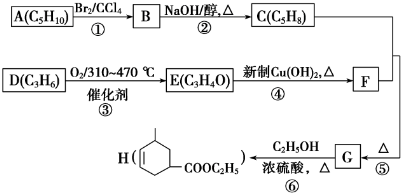
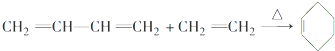
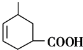 .
. .
.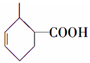 .
.