题目内容
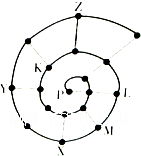
如表是元素周期表的一部分,根据①~⑩在周期表中的位置,用元素符号或化学式回答下列问题:

(1)金属性最强的元素是______,最容易与H2反应单质是______.
(2)⑤位于周期表中第______周期,______族;其原子结构示意图为______.
(3)最高价氧化物所对应的水化物酸性最强的是______(填化学式).
(4)②与⑧形成的化合物属于______(填“离子化合物”或“共价化合物”).
(5)最高价氧化物既能与酸反应又能与碱反应的是______(填化学式).
(6)③和⑦对应的氢化物较稳定的是______(填化学式).
(7)⑤和⑥的原子半径较大是______,⑤和⑥的最高价氧化物对应水化物的碱性较强的是______(填化学式).
(8)用电子式表示⑤和⑨元素形成的化合物的形成过程______.

(1)金属性最强的元素是______,最容易与H2反应单质是______.
(2)⑤位于周期表中第______周期,______族;其原子结构示意图为______.
(3)最高价氧化物所对应的水化物酸性最强的是______(填化学式).
(4)②与⑧形成的化合物属于______(填“离子化合物”或“共价化合物”).
(5)最高价氧化物既能与酸反应又能与碱反应的是______(填化学式).
(6)③和⑦对应的氢化物较稳定的是______(填化学式).
(7)⑤和⑥的原子半径较大是______,⑤和⑥的最高价氧化物对应水化物的碱性较强的是______(填化学式).
(8)用电子式表示⑤和⑨元素形成的化合物的形成过程______.
由元素在周期表中的位置可知①为H元素,②为C元素,③为N元素,④为F元素,⑤为Na元素,⑥为Al元素,⑦为P元素,⑧为S元素,⑨为Cl元素,⑩为Ar元素,(1)同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下,元素的金属性逐渐增强,非金属性逐渐减弱,则金属性最强的为Na,非金属性最强的为F,元素的非金属性越强,对应的单质越易与氢气发生反应,则最容易与H2反应单质是F2,
故答案为:Na;F2;
(2)⑤位于周期表中第三周期,ⅠA族,原子核外有3个电子层,最外层电子数为1,则原子结构示意图为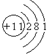 ,
,
故答案为:三;ⅠA; ;
;
(3)最高价氧化物所对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(4)②与⑧形成的化合物为CS2,为共价化合物,故答案为:共价化合物;
(5)最高价氧化物既能与酸反应又能与碱反应的是Al2O3,故答案为:Al2O3;
(6)非金属性N>P,元素的非金属性越强,对应的氢化物越稳定,故答案为:NH3;
(7)同周期元素从左到右元素的原子半径逐渐减小,则原子半径较大的为Na,金属性Na>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性较强的为NaOH,
故答案为:Na;NaOH;
(8)⑤和⑨元素形成的化合物为NaCl,用电子表示形成过程为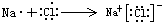 ,故答案为:
,故答案为: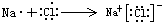 .
.
故答案为:Na;F2;
(2)⑤位于周期表中第三周期,ⅠA族,原子核外有3个电子层,最外层电子数为1,则原子结构示意图为
 ,
,故答案为:三;ⅠA;
 ;
;(3)最高价氧化物所对应的水化物酸性最强的是HClO4,故答案为:HClO4;
(4)②与⑧形成的化合物为CS2,为共价化合物,故答案为:共价化合物;
(5)最高价氧化物既能与酸反应又能与碱反应的是Al2O3,故答案为:Al2O3;
(6)非金属性N>P,元素的非金属性越强,对应的氢化物越稳定,故答案为:NH3;
(7)同周期元素从左到右元素的原子半径逐渐减小,则原子半径较大的为Na,金属性Na>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性较强的为NaOH,
故答案为:Na;NaOH;
(8)⑤和⑨元素形成的化合物为NaCl,用电子表示形成过程为
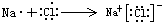 ,故答案为:
,故答案为: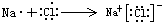 .
.
练习册系列答案
相关题目
 (4)E能与AB形成配合物,其中E提供______,AB提供______.
(4)E能与AB形成配合物,其中E提供______,AB提供______.