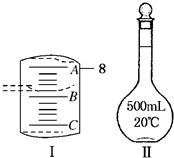
题目内容
12.(1)下列物质中:①Na ②Na2O ③CO2④NH3 ⑤H2SO4⑥Ba(OH)2⑦NaCl ⑧蔗糖 ⑨NaCl溶液.属于电解质的是②⑤⑥⑦,属于非电解质的是③④⑧,能导电的是①⑨.(用序号填写)
(2)写出下列物质的电离方程式
①Cu(NO3)2Cu(NO3)2=Cu2++2NO3-
②NaHCO3NaHCO3=Na++HCO3-
(3)在Na2O2与CO2的反应里,每消耗1mol过氧化钠,则生成11.2升O2(标况)时,转移电子数为6.02×1023.
分析 (1)在水溶液中或熔融状态下能导电的化合物为电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质;有自由移动的离子或自由移动的电子的物质能导电;
(2)分清电解质的强弱,强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答;
(3)过氧化钠与二氧化碳的反应为歧化反应,1mol过氧化钠转移1mol电子,消耗1mol二氧化碳,据此分析.
解答 解:(1)①Na能导电;但由于是单质,故既不是电解质也不是非电解质;
②Na2O无自由移动的离子,不能导电,但在熔融状态下能导电,故为电解质;
③CO2无自由移动的离子,不能导电,在水溶液中导电和其本身无关,在熔融状态下不能导电,故为非电解质;
④NH3 无自由移动的离子,不能导电,在水溶液中导电和其本身无关,在熔融状态下不能导电,故为非电解质;
⑤H2SO4无自由移动的离子,不能导电,但溶于水后能导电,故为电解质;
⑥Ba(OH)2无自由移动的离子,不能导电,但在水溶液中和熔融状态能导电,故为电解质;
⑦NaCl无自由移动的离子,不能导电,但在水溶液中和熔融状态下能导电,故为电解质;
⑧蔗糖无自由移动的离子,不能导电,在水溶液中和熔融状态下均不能导电,故为非电解质;
⑨NaCl溶液能导电,但由于是混合物,故既不是电解质也不是非电解质.
故答案为:②⑤⑥⑦;③④⑧;①⑨;
(2)①Cu(NO3)2 是强电解质,在溶液中能完全电离为铜离子和硝酸根,故电离方程式为:Cu(NO3)2=Cu2++2NO3-;故答案为:Cu(NO3)2=Cu2++2NO3-;
②NaHCO3在溶液中能完全电离为钠离子和碳酸氢根离子,故电离方程式为:NaHCO3=Na++HCO3-;故答案为:NaHCO3=Na++HCO3-;
(3)过氧化钠与二氧化碳的反应为歧化反应,1mol过氧化钠转移1mol电子,个数为6.02×1023个,生成0.5mol氧气,在标况下体积为11.2L,故答案为:11.2;6.02×1023;
点评 本题考查了电解质、非电解质和物质导电的判断以及电离方程式的书写,明确电解质的强弱及电离方程式的书写规则是解本题关键,注意原子团不能拆,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 80% | B. | 20% | C. | 40% | D. | 60% |
| A. | Na原子结构示意图: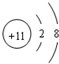 | B. | 乙烷的结构简式:CH3CH3 | ||
| C. | HClO的结构式:H-Cl-O | D. | CH4分子的比例模型: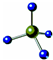 |
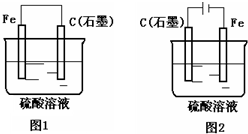
| A. | 两装置中,铁电极均要消耗 | |
| B. | 图2装置中两极均有气泡产生 | |
| C. | 图1装置铁电极上发生的电极反应为:Fe-3e-═Fe3+ | |
| D. | 随着反应的进行,图1装置中溶液的pH增大,图2装置中溶液的pH不变 |
| A. | 过氧化钙(CaO2)的电子式: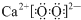 | |
| B. | ${\;}_8^{16}{O^{2-}}$离子的结构示意图: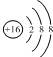 | |
| C. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{94}^{144}$Pu | |
| D. | 葡萄糖的结构简式:C6H12O6 |