题目内容
3.化学实验的基本操作是完成化学实验的关键,下列实验操作正确的是( )①用50mL量筒量取5.2mL稀硫酸;
②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量117.7g氯化钠晶体;
④用碱式滴定管量取23.10mL溴水;
⑤用试管高温灼烧各种钠的化合物;
⑥用250mL容量瓶配制250mL 0.2mol•L-1的NaOH溶液;
⑦用浓盐酸清洗做过KMnO4分解实验的试管;
⑧将浓硝酸保存在无色试剂瓶中.
| A. | ①②④ | B. | ②③④⑤ | C. | ③⑥⑦ | D. | ②⑤⑥⑧ |
分析 ①选取的量筒规格应该等于或稍微大于量筒溶液体积;
②互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏方法分离;
③托盘天平的感量是0.1g;
④溴能腐蚀橡胶;
⑤二氧化硅和NaOH反应生成硅酸钠;
⑥配制一定物质的量浓度溶液时,选取容量瓶的规格应该等于或稍微大于配制溶液体积;
⑦浓盐酸和二氧化锰在加热条件下发生氧化还原反应;
⑧见光易分解的物质应该保存在棕色试剂瓶中.
解答 解:①选取的量筒规格应该等于或稍微大于量筒溶液体积,所以用10mL量筒量取5.2mL稀硫酸,故错误;
②互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏方法分离,苯和四氯化碳互溶,应该采用蒸馏方法分离,故错误;
③托盘天平的感量是0.1g,所以用托盘天平称量117.7g氯化钠晶体,故正确;
④溴能腐蚀橡胶,应该用酸式滴定管量取溴,故错误;
⑤二氧化硅和NaOH反应生成硅酸钠,所以不能用试管高温灼烧各种钠的化合物,故错误;
⑥配制一定物质的量浓度溶液时,选取容量瓶的规格应该等于或稍微大于配制溶液体积,则用250mL容量瓶配制250mL 0.2mol•L-1的NaOH溶液,故正确;
⑦浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成可溶性的氯化锰,所以可以用浓盐酸清洗做过KMnO4分解实验的试管,故正确;
⑧见光易分解的物质应该保存在棕色试剂瓶中,硝酸见光易分解,所以应该用棕色试剂瓶盛放浓硝酸,故错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器选取、物质性质、药品保存等知识点,明确常见仪器使用方法、物质性质是解本题关键,注意容量瓶、量筒规格的选取方法,题目难度不大.

练习册系列答案
相关题目
13.下列说法中,不正确的是( )
| A. | 常温下可用铁制容器盛装浓硝酸 | B. | 氧化铁常用作红色油漆和涂料 | ||
| C. | 硅胶常用作食品、药品干燥剂 | D. | 生石灰可用作食品的抗氧化剂 |
14.水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O.下列有关该反应的说法中,不正确的是( )
| A. | a=4 | B. | 还原剂是Fe2+ | ||
| C. | 氧化剂是O2 | D. | Y的化学式为Fe3O4 |
11.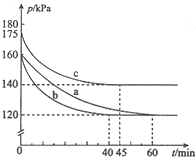 反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )
反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )
 反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )
反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列说法正确的是( )| A. | 实验a从反应开始至达到平衡时的反应速率v(AX5)=0.17 mol•L-1•min-1 | |
| B. | 实验b达到平衡时,化学平衡常数为10 | |
| C. | 实验c达到平衡时,AX3的平衡转化率为50% | |
| D. | 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为b>c>a |