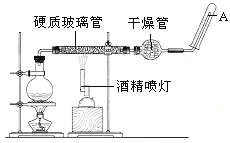
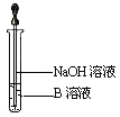
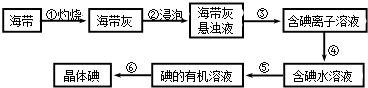
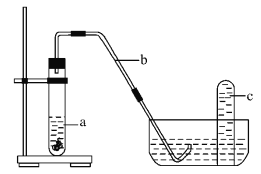
题目内容
【题目】某废水中含有CN-和Cr2O72-等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:
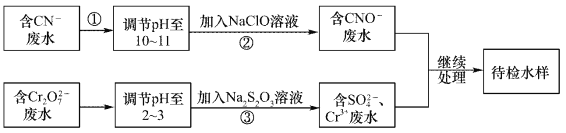
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为____________。
(2)步骤③的反应的离了方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是___________________。
【答案】 CN-+ClO- = CNO-+Cl- 2.4 调节废水pH,使其转化为Cr(OH)3沉淀除去
【解析】(1)步骤②中,CN-被ClO-氧化为CNO-,因为是在碱性环境中,所以ClO-只能被还原为Cl-,因此反应的离子方程式为CN-+ClO- = CNO-+Cl-;(2)根据方程式可知,在反应中Cr元素的化合价从+6价降低到+3价,得到3个电子,所以0.4 mol Cr2O72-转化为Cr3+时转移电子的物质的量=0.4mol×(6-3)×2=2.4mol;(3)熟石灰是强碱,溶于水显碱性,所以含Cr3+废水中加入熟石灰进一步处理的目的是调节废水pH,使其转化为Cr(OH)3沉淀除去。
【题型】综合题
【结束】
30
【题目】用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如图所示:

已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。
(1)写出反应器中的化学方程式:________________。
(2)在实验室过滤操作中所用的玻璃仪器有_____________,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:____________。
(3)该流程中哪些物质可以循环使用:_____________。(用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:__________________。
【答案】 H2SiF6+ K2SO4 = H2SO4+K2SiF6↓ 烧杯、漏斗、玻璃棒 氟硅酸钾不溶于酒精,减少用水洗涤溶解氟硅酸钾损失 H2SO4、K2SO4 6HF+SiO2 = H2SiF6+2H2O
【解析】氟硅酸加入硫酸钾发生反应生成氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,过滤得到硫酸和氟硅酸钾,干燥后在热水中水解成氟化钾、氟化氢及硅酸,加入浓硫酸反应得到硫酸钾、氟化氢、和四氯化硅等,净化冷凝,通过精馏得到纯净的氟化氢;(1)氟硅酸加入硫酸钾发生反应生成氟硅酸钾和硫酸,反应器中的化学方程式为:H2SiF6+ K2SO4 = H2SO4+K2SiF6↓;(2)依据过滤装置和过程选择需要的玻璃仪器为漏斗、烧杯、玻璃棒,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤而不是用水,其目的是氟硅酸钾不溶于酒精,减少用水洗涤溶解氟硅酸钾损失;(3)反应过程中参与反应,在反应过程中又重新生成的物质可以循环使用,分析流程判断流程中硫酸和硫酸钾在苯环过程中先参加反应,随后又生成,可以循环使用,故答案为:H2SO4、K2SO4;(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6 和水,依据原子守恒配平书写化学方程式为:6HF+SiO2 = H2SiF6+2H2O。