题目内容
15.下列反应的离子方程式正确的是( )| A. | 少量二氧化硫气体通入到漂白粉溶液中;Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| B. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 少量的钠投入足量的水中:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
分析 A.少量SO2通入Ca(ClO)2溶液中,发生氧化还原反应生成硫酸钙;
B.铁离子与碘离子反应生成碘单质和亚铁离子;
C.钠与水反应生成氢氧化钠和氢气;
D.溶液的pH=7,则氢离子与氢氧根离子的总物质的量相等.
解答 解:A.少量SO2通入Ca(ClO)2溶液中,次氯酸将亚硫酸钙氧化成硫酸钙,正确的离子反应为:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故错误;
B.铁离子与碘离子发生氧化还原反应,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故B错误;
C.少量的钠投入足量的水中,二者反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故C正确;
D.硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,则硫酸氢钠与氢氧化钡的物质的量之比为2:1,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D正确;
故选CD.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
3.由一种阳离子和两种酸根离子组成的盐称混盐.下列关于混盐Na4S2O3的有关判断,不正确的是( )
| A. | 向溶液中加入酚酞溶液变红,说明该混盐水溶液呈碱性 | |
| B. | 向该混盐中加入稀H2SO4可以产生使品红褪色的气体 | |
| C. | 该混盐在酸性条件下可以产生淡黄色浑浊 | |
| D. | 用玻璃棒蘸取该混盐溶液灼烧,火焰呈黄色,说明溶液中含有Na+ |
10.2014年诺贝尔化学奖获得者Moerner早在1989年就利用吸收光谱在4K温度条件下观察到了单个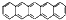 并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
 并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )| A. | 4 | B. | 6 | C. | 7 | D. | 11 |
20.下列关于反应 4Li+2SOC12═4LiCl+S+SO2↑的叙述中,不正确的是( )
| A. | SOCl2是氧化剂,Li是还原剂 | |
| B. | 2 mol SOCl2参加反应,共转移4 mol电子 | |
| C. | 若将该反应设计成原电池,SOCl2在正极发生反应 | |
| D. | 若将该反应设计成原电池,可用稀硫酸作电解质溶液 |
4.一定温度下,可逆反应A(气)+3B(气)?2C(气)在一定容积的密闭容器中进行,达到平衡的标志是( )
| A. | 混合气体的密度不再变化 | B. | A、B、C的浓度相等 | ||
| C. | 混合气体的压强不再变化 |

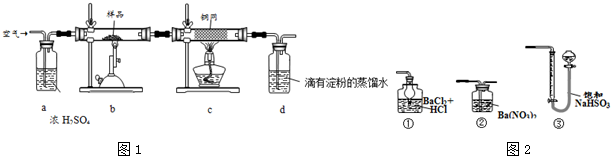
 .
.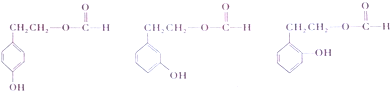 .
.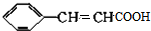 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$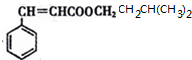 +H2O.
+H2O.