题目内容
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液: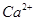 、、H+、 、、H+、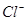 、 、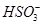 |
B.能使pH试纸呈红色的溶液:Na+、NH+4、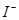 、 、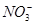 |
C.FeCl2溶液:K+、、Na+、、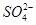 、、 、、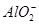 |
D. =0.1 mol/L的溶液:Na+、K+、 =0.1 mol/L的溶液:Na+、K+、 、 、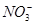 |
D
解析试题分析: A. H+和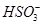 反应会生成二氧化硫气体不能共存,错误;C.Fe2+为浅绿色,与无色溶液不符,故C错误;B.使pH试纸呈红色的溶液,显酸性,H+、NO3-会和碘离子发生氧化还原反应,不能共存,故B错误;D.25℃时,
反应会生成二氧化硫气体不能共存,错误;C.Fe2+为浅绿色,与无色溶液不符,故C错误;B.使pH试纸呈红色的溶液,显酸性,H+、NO3-会和碘离子发生氧化还原反应,不能共存,故B错误;D.25℃时, =0.1 mol/L的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子之间能大量共存,故D正确;故选D.
=0.1 mol/L的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子之间能大量共存,故D正确;故选D.
考点:本题考查了离子的共存,明确习题中的信息是解答本题的关键,注意离子之间的反应来解答,题目难度中等。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
下列离子方程式书写正确的是( )
| A.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42- + H+ + Ba2+ + OH-=BaSO4↓+ H2O |
| B.少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-= BaCO3↓+H2O |
C.硫氢化钠发生水解:HS-+H2O H3O++S2- H3O++S2- |
| D.FeS固体加入到用硫酸酸化的H2O2溶液中: 2Fe2++2H++H2O2=2Fe3++2H2O |
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
| A.含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- |
| B.含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
| C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 |
| D.含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ |
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量的关系如图所示则原溶液中Al3+、Mg2+、NH4+的物质的量分别为
| A.2 mol、3 mol、8 mol |
| B.3 mol、2 mol、8 mol |
| C.2 mol、3 mol、4 mol |
| D.3 mol、2 mol、4 mol |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O ="=" Cu(OH)2↓+ 2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH― NH3↑+H2O NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4―+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
能正确表示下列化学反应的离子方程式的是( )
| A.氢氧化钡溶液与硫酸的反应 OH-+H+ = H2O |
| B.金属钠与水反应 Na + H2O = Na++ OH- + H2 |
| C.铜片插入硝酸银溶液中 Cu +Ag+ = Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |
下列实验设计及其对应的离子方程式均正确的是( )
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| D.用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
下列各组离子中,在溶液中能大量共存,加入氢氧化钠溶液有沉淀析出,加入稀盐酸有气体放出的是
| A.Na+、Ca2+、SO42—、CO32— | B.K+、Ba2+、HCO3—、Cl— |
| C.K+、Al3+、SO42—、NO3— | D.K+、Na+、CO32—、SO42— |
下列评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与稀硝酸反应:2 Fe3O4+18H+=6Fe3++H2↑+8H2O | 正确 |
| B | 向碳酸镁中加入稀盐酸: CO32—+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42—=BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br—+2Cl2="2" Fe3++4Cl—+Br2 | 错误:Fe2+与Br—的化学计量数之比应为1:2 |