题目内容
能正确表示下列化学反应的离子方程式的是( )
| A.氢氧化钡溶液与硫酸的反应 OH-+H+ = H2O |
| B.金属钠与水反应 Na + H2O = Na++ OH- + H2 |
| C.铜片插入硝酸银溶液中 Cu +Ag+ = Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |
D
解析试题分析:A、氢氧化钡溶液与硫酸的反应:漏掉离子反应,应为Ba2++2OH-+2H++ SO42-= 2H2O+BaSO4 B、金属钠与水反应:原子不守恒,应为2Na +2 H2O = 2Na++ 2OH- + H2,错误; C、 铜片插入硝 酸银溶液中:电荷不守恒,应为Cu +2Ag+ = Cu2+ + 2Ag,错误;D、碳酸钙溶于稀盐酸中:
CaCO3+2H+=Ca2++H2O+CO2,正确。
考点:考查离子方程式正误判断。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-=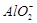 +H2↑ +H2↑ |
B.硫酸镁溶液跟氢氧化钡溶液反应: +Ba2+=BaSO4↓ +Ba2+=BaSO4↓ |
| C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
D.铜片跟稀硝酸反应:Cu+ +4H+=Cu2++NO↑+2H2O +4H+=Cu2++NO↑+2H2O |
下列微粒能够大量共存的是( )
| A.在pH=14的溶液中:HCO3-、Cl-、SO32-、K+ |
| B.在无色透明溶液中:Cu2+、K+、SO42-、Cl一 |
| C.在苯酚溶液中:Br-、Fe3+、NO3-、Cl- |
| D.在新制Cu(OH)2悬浊液中: CH3CHO、C2H5OH、SO42-、Na+ |
下列反应的离子方程式正确的是( )
| A.澄清石灰水中滴加过量的小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| B.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| C.H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O |
D.尼泊金酸(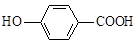 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: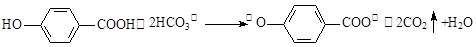 |
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液: 、、H+、 、、H+、 、 、 |
B.能使pH试纸呈红色的溶液:Na+、NH+4、 、 、 |
C.FeCl2溶液:K+、、Na+、、 、、 、、 |
D. =0.1 mol/L的溶液:Na+、K+、 =0.1 mol/L的溶液:Na+、K+、 、 、 |
能正确表示下列反应的离子方程式为
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-+ H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2 + ClO- + 2OH–= SO42-+Cl-+ H2O |
| C.硫化钡加入稀硫酸:BaS + 2H+ = H2S↑+ Ba2+ |
| D.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O="3I" 2+6OH- |
下列示意图与对应的反应情况符合的是( )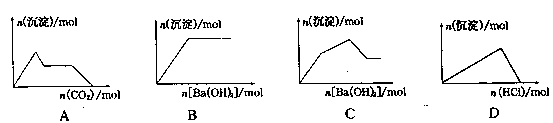
| A.向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
| B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
| C.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
| D.向NaAlO2溶液中逐滴加入盐酸至过量 |
下列各组溶液中离子,能在溶液中大量共存的是:
| A.H+、Ca2+、NO3-、CO32- | B.K+、Na+、Cl-、NO3- |
| C.Ag+、Na+、Cl-、K+ | D.NH4+、K+、NO3-、SO42- |
某溶液可能含有Cl-、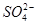 、
、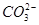 、NH+ 4、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
、NH+ 4、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
| A.NH+ 4Fe3+一定存在, K+可能存在 |
| B.Cl?一定存在,且c(Cl?)≤0.4 mol/L |
C.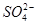 、NH+ 4Fe3+一定存在,且物质的量浓度均为0.02 mol/L 、NH+ 4Fe3+一定存在,且物质的量浓度均为0.02 mol/L |
D.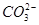 、Al3+一定不存在,K+一定存在 、Al3+一定不存在,K+一定存在 |