题目内容
【题目】将64gCu与一定浓度的HNO3反应,Cu全部反应完后,收集到标准状况下NO和NO2混合气体22.4L。请回答下列问题:
(1)Cu与HNO3反应生成NO的离子方程式为____________________。该反应体现的HNO3的性质为______(填字母)。
A.强氧化性 B.酸性 C.不稳定性 D.易挥发性
(2)参加反应的Cu转移电子的数目为______。
(3)该反应中消耗HNO3的物质的量为______。
【答案】3Cu+8H+ +2NO3-=3Cu2+ + 2NO↑ +4H2O A,B 2NA 3mol
【解析】
(1)Cu与HNO3反应生成NO的化学方程式为3Cu+8HNO3=3Cu(NO3)2 +2NO↑ +4H2O,离子反应方程式为:3Cu+8H+ +2NO3-=3Cu2+ + 2NO↑ +4H2O;反应物HNO3中氮的化合价由+5变为+2价,体现强氧化性,同时生成了硝酸盐,体现了酸性,故选A、B;
(2)64gCu全部反应转化为Cu2+,64gCu的物质的量=![]() =1mol,而1mol铜转移2mol电子,即2NA个电子,故答案为:2NA;
=1mol,而1mol铜转移2mol电子,即2NA个电子,故答案为:2NA;
(3)根据反应原理和质量守恒,消耗HNO3中的N全部存在于Cu(NO3)2、NO和NO2中,而NO和NO2混合气体22.4L,在标准状况下为1mol,这部分消耗了1mol HNO3;1mol铜全部反应可生成1mol Cu(NO3)2,这部分消耗了2mol HNO3,故答案为3mol。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
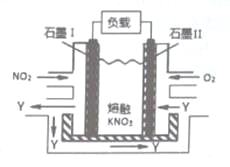
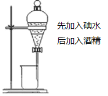
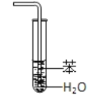
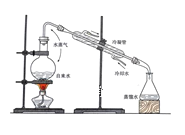
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述正确的是( )
|
|
|
|
① | ② | ③ | ④ |
A.装置①中溶液上层无色,下层紫红色B.装置②可用于吸收HCl气体,并防止倒吸
C.装置③可用于制取蒸馏水D.装置④中液体蒸干后停止加热