题目内容
金属钠、钙等在氧气中燃烧可生成过氧化物.从组成上分析,过氧化物为金属氧化物,可能会与水、二氧化碳、二氧化硫反应生成盐.
(1)取一支小试管,向其中加入过氧化纳固体,然后加入少量蒸馏水,将带余烬的小木条插入试管中,观察到的现象是______,反应后,向其中滴入酚酞溶液,观察到的现象是______.该反应的化学方程式为______.
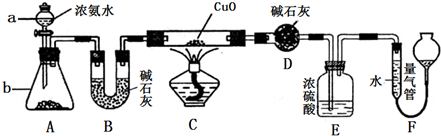
(2)有两个实验小组的同学用如图所示的装置进行实验,来探究过氧化钠与二氧化硫的反应

请回答下列问题:
①装置C中氢氧化钠溶液的作用是______
②甲组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:______请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3.______
③乙组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:
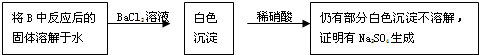
上述方案是否合理?______.请简要说明两点理由:①______;②______.
(3)为了解决养金鱼的吸氧问题,可在水中加入过氧化钙.某过氧化钠样品2.0g,加入到足量的水中,在标准状况下生成了224mL氧气.试计算该样品中含过氧化钙的质量分数.
(1)取一支小试管,向其中加入过氧化纳固体,然后加入少量蒸馏水,将带余烬的小木条插入试管中,观察到的现象是______,反应后,向其中滴入酚酞溶液,观察到的现象是______.该反应的化学方程式为______.
(2)有两个实验小组的同学用如图所示的装置进行实验,来探究过氧化钠与二氧化硫的反应

请回答下列问题:
①装置C中氢氧化钠溶液的作用是______
②甲组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:______请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3.______
③乙组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理?______.请简要说明两点理由:①______;②______.
(3)为了解决养金鱼的吸氧问题,可在水中加入过氧化钙.某过氧化钠样品2.0g,加入到足量的水中,在标准状况下生成了224mL氧气.试计算该样品中含过氧化钙的质量分数.
(1)过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;氧气能使带火星的木条复燃;反应后的溶液是氢氧化钠溶液,是碱遇到酚酞变红;
故答案为:有气体放出,小木条复燃,溶液变红,2Na2O2+2H2O=4NaOH+O2↑;
(2)①二氧化硫是污染性气体,装置C中氢氧化钠溶液的作用是吸收二氧化硫气体;
故答案为:吸收二氧化硫气体;
②Na2O2与SO2反应生成了Na2SO3和O2,结合得失电子守恒知,该反应方程式为:2Na2O2+2SO2=2Na2SO3+O2;验证白色固体是亚硫酸钠的方法利用亚硫酸钠和酸反应生成的二氧化硫具有漂白性检验,实验步骤为:取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体;
故答案为:2Na2O2+2SO2=4Na2SO3+O2↑,取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体.
③在检验硫酸根离子前要排除亚硫酸根离子的干扰,亚硫酸根离子具有还原性,过氧化钠和硝酸都能把亚硫酸根离子氧化生成硫酸根离子,对硫酸根离子造成干扰,所以乙同学的方案不合理,
故答案为:不合理.①稀硝酸能使亚硫酸钡转化为硫酸钡.②若反应后残留过氧化钠,它溶于水后能将SO32-转化为SO42-.
(3)样品中含过氧化钙的物质的量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
2mol1mol
x0.01mol
x=0.02mol;
CaO2(%)=
×100%=72%;
答:该样品中含过氧化钙的质量分数为72%;
故答案为:有气体放出,小木条复燃,溶液变红,2Na2O2+2H2O=4NaOH+O2↑;
(2)①二氧化硫是污染性气体,装置C中氢氧化钠溶液的作用是吸收二氧化硫气体;
故答案为:吸收二氧化硫气体;
②Na2O2与SO2反应生成了Na2SO3和O2,结合得失电子守恒知,该反应方程式为:2Na2O2+2SO2=2Na2SO3+O2;验证白色固体是亚硫酸钠的方法利用亚硫酸钠和酸反应生成的二氧化硫具有漂白性检验,实验步骤为:取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体;
故答案为:2Na2O2+2SO2=4Na2SO3+O2↑,取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体.
③在检验硫酸根离子前要排除亚硫酸根离子的干扰,亚硫酸根离子具有还原性,过氧化钠和硝酸都能把亚硫酸根离子氧化生成硫酸根离子,对硫酸根离子造成干扰,所以乙同学的方案不合理,
故答案为:不合理.①稀硝酸能使亚硫酸钡转化为硫酸钡.②若反应后残留过氧化钠,它溶于水后能将SO32-转化为SO42-.
(3)样品中含过氧化钙的物质的量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
2mol1mol
x0.01mol
x=0.02mol;
CaO2(%)=
| 0.02mol×72g/mol |
| 2.0g |
答:该样品中含过氧化钙的质量分数为72%;

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
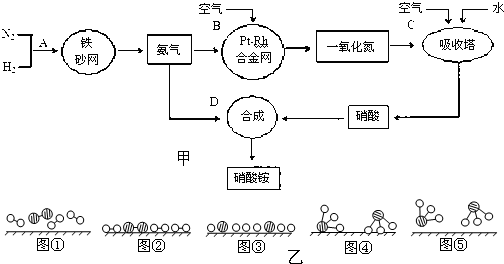
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______、______.