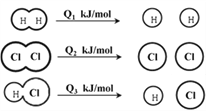
题目内容
【题目】A、B、D、E、F、G是原子序数依次增大的六种短周期元素。A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15。回答下列问题:
(1)E元素在元素周期表中的位置是___________;A离子的结构示意图为____________。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为________。
(3)①B2A2中含有___________键和___________键。
②该物质与水反应的化学反应方程式为___________________。
(4)下列说法正确的是____________(填字母序号)。
①B、D、E原子半径依次减小
②六种元素的最高正化合价均等于其原子的最外层电子数
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
(5)在E、F、G的最高价氧化物对应水化物中,酸性最强的为__________(填化学式),用原子结构解释原因:同周期元素电子层数相同,从左至右,__________,得电子能力逐渐增强,元素非金属性逐渐增强。
【答案】 第三周期第IVA族 ![]() 2Al + 2OH- +2H2O = 2AlO2- + 3H2↑ 离子 非极性共价 2Na2O2 + 2H2O = O2↑ + 4NaOH ① HClO4 半径逐渐减小
2Al + 2OH- +2H2O = 2AlO2- + 3H2↑ 离子 非极性共价 2Na2O2 + 2H2O = O2↑ + 4NaOH ① HClO4 半径逐渐减小
【解析】A、B、D、E、F、G是原子序数依次增大的六种短周期元素,A和B能形成B2A和B2A2两种化合物,A为O元素,B为Na元素;B、D、G的最高价氧化物对应水化物两两之间都能反应,D为Al元素;结合“D、F、G原子最外层电子数之和等于15”,则F为P元素,G为Cl元素,E为Si元素。
A、B、D、E、F、G是原子序数依次增大的六种短周期元素,A和B能形成B2A和B2A2两种化合物,A为O元素,B为Na元素;B、D、G的最高价氧化物对应水化物两两之间都能反应,D为Al元素;结合“D、F、G原子最外层电子数之和等于15”,则F为P元素,G为Cl元素,E为Si元素。
(1)E为Si元素,Si原子核外有3个电子层,最外层电子数为4,E元素在元素周期表中的位置是第三周期IVA族。A离子为O2-,A离子的结构示意图为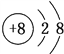 。
。
(2)B的最高价氧化物对应水化物为NaOH,Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)B2A2为Na2O2。
① Na2O2的电子式为![]() ,Na2O2中含有离子键和非极性共价键。
,Na2O2中含有离子键和非极性共价键。
②Na2O2与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。
(4)①根据同周期从左到右主族元素的原子半径依次减小,B、D、E原子半径依次减小,①正确;②A元素为O,O没有最高正化合价,②错误;③D的最高价氧化物对应水化物为Al(OH)3,Al(OH)3不溶于氨水,③错误;④非金属性:Cl(G)![]() P(F),气态氢化物稳定性HCl
P(F),气态氢化物稳定性HCl![]() PH3,非金属性:O(A)
PH3,非金属性:O(A)![]() P(F),气态氢化物稳定性H2O
P(F),气态氢化物稳定性H2O![]() PH3,④错误;正确的是①,答案选①。
PH3,④错误;正确的是①,答案选①。
(5)E、F、G依次为Si、P、Cl,根据同周期从左到右非金属元素的最高价氧化物对应水化物酸性逐渐增强,酸性最强的为HClO4。用原子结构解释原因:同周期元素电子层数相同,从左到右,核电荷数依次增大,原子半径逐渐减小,得电子能力逐渐增强,元素非金属性逐渐增强。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案