题目内容
12.湿法冶金中,把质量为m g的铁片放入CuSO4溶液中,过一会儿取出干燥,铁片的质量变为n g,则被氧化的铁的质量是( )| A. | 8(n-m)g | B. | 8(m-n)g | C. | 7(m-n)g | D. | 7(n-m)g |
分析 铁与硫酸铜反应生成铜和硫酸亚铁,反应生成铜的质量大于消耗铁的质量,因此,反应后所得固体质量增加的;利用反应的化学方程式,根据固体增加量可计算反应生成铜的质量.
解答 解:反应后置换出来铜的覆盖在铁片上,且生成铜的质量大于反应掉的铁的质量,铁片质量增加了ng-mg=(n-m)g.
设被氧化的铁的质量为x.
Fe+CuSO4=FeSO4+Cu 铁片质量增加
56 64 64-56=8
x (n-m)g
$\frac{56}{x}=\frac{8}{(n-m)g}$
x=7(n-m)g
故选:D.
点评 利用反应前后固体质量的差,根据反应的化学方程式计算反应生成金属的质量,可以把复杂的计算过程简单化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2. (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4>H3PO4; HClO4>HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
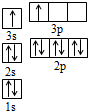
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.
 (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4>H3PO4; HClO4>HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.
4.能正确表示下列反应的离子方程式是( )
| A. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O═C6H5OH+HCO3- | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+2H2O | |
| D. | 醋酸溶液中加入少量CaCO3固体:CaCO3+2H+═Ca2++H2O+CO2↑ |
11.日本核泄漏事故释放的放射性物质中含有碘-131,下列关于${\;}_{53}^{131}$I的说法正确的是( )
| A. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I是同一种核素 | |
| B. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I互为同位素 | |
| C. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I都含有53个电子 | |
| D. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I都含有53个中子 |
8.下列反应中,硝酸既表现酸性,又表现氧化性的是( )
| A. | Fe(OH)2跟稀硝酸反应 | B. | Fe2O3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Al(OH)3跟稀硝酸反应 |
6.下列有关化学用语的使用不正确的是( )
| A. | 乙烯的比例模型: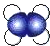 | B. | 3,3-二甲基戊烷的键线式: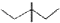 | ||
| C. | 对甲基苯甲醇的结构简式: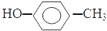 | D. | 醛基的结构简式:-CHO |
 +6KMnO4+9H2SO4→
+6KMnO4+9H2SO4→ +3K2SO4+6MnSO4+14H2O.
+3K2SO4+6MnSO4+14H2O.