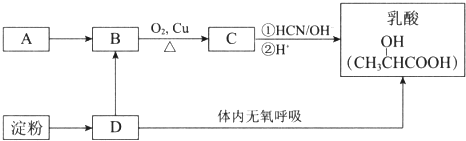
题目内容
【题目】将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu= 2FeCl2+CuCl2。
(1)请用双线桥法标出电子转移的方向和数目___________。
(2)在该反应中,氧化剂是___________, ___________元素被氧化。
(3)当有0.3mol电子发生转移时,发生反应的Cu的质量为___________ g。
【答案】 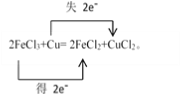 FeCl3 Cu 9.6
FeCl3 Cu 9.6
【解析】(1)化合价升高的元素是Cu,在反应中失去电子,化合价降低的元素是Fe,在反应中得到电子,化合价升高数=化合价降低数=转移电子数=2,则用双线桥法表示电子转移的方向和数目如下: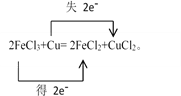 ,故答案为:
,故答案为: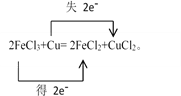 ;
;
(2)化合价降低的是Fe元素,所在的反应物FeCl3是氧化剂,化合价升高的是Cu元素,所在的反应物Cu是还原剂,被氧化,故答案为:FeCl3;Cu;
(3)根据方程式可知,当有2mol电子转移时,发生反应的Cu的物质的量是1mol,当有0.3mol电子发生转移时,发生反应的Cu的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,故答案为:9.6。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目