题目内容
【题目】CuSO4 是一种重要的化工原料,其有关制备途径及性质如图所示。
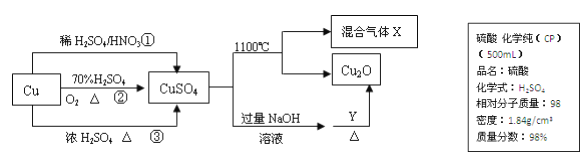
(1)现要用如上图所示的浓硫酸来配制步骤①中所需要的 1mol/L 的稀硫酸 480mL,需用这种浓硫酸的体积为________mL。(保留到小数点后 1 位)
(2)配制该稀硫酸溶液所用到的玻璃仪器除了玻璃棒、量筒、烧杯之外还有_____、_______。
(3)下列哪些操作会使所配的稀硫酸浓度减小________。
A.洗涤烧杯和玻璃棒的溶液未转入容量瓶
B.定容时,眼睛仰视溶液凹液面最低点
C. 容量瓶中原残留少量蒸馏水
D.定容摇匀后容量瓶液面低于刻度线,又加水定容到刻度线
E.量取浓硫酸时量筒内有少量蒸馏水
(4)制取硫酸铜的途径①、②、 ③中,途径______能更好地体现绿色化学思想。
(5)请写出途径③的化学反应方程式________________。
(6)配制 1000mL 0.1mol/L 的硫酸铜溶液,需用托盘天平称取_______g 胆矾。
【答案】 27.2mL 500mL容量瓶 胶头滴管 ABDE ② Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 25.0g
CuSO4+SO2↑+2H2O 25.0g
【解析】(1)配制步骤①中所需要的1mol/L的稀硫酸480mL,实验室中无此规格容量瓶,需要选择500mL容量瓶,计算配制1mol/L的稀硫酸500mL,图示中浓硫酸的物质的量浓度=(1000×1.84×98%)/98mol/L=18.4mol/L,结合溶液中溶质物质的量相同计算可知18.4mol/L×VL=1mol/L×0.500L,解得V=0.0272L=27.2mL;(2)用浓溶液配制稀溶液一般步骤:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取一定体积的浓溶液,然后在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,因此还缺少胶头滴管、500mL容量瓶;(3)A.洗涤烧杯和玻璃棒的溶液未转入容量瓶,配制溶液中溶质物质的量减小,浓度偏低,A正确;B.定容时,眼睛仰视溶液将凹液面最低点与容量瓶刻度线相切,加入水超出刻度线,溶液浓度减小,B正确;C.容量瓶中原残留少量蒸馏水对配制溶液浓度无影响,C错误;D.定容摇匀后容量瓶液面低于刻度线,又加水定容到刻度线,最后溶液体积超出刻度线,溶液浓度减小,D正确;E.量取浓硫酸时量筒内有少量蒸馏水,溶质取用量减小,配制溶液浓度减小,E正确;答案选ABDE;(4)相对于途径①、③,途径②的优点:制取等质量胆矾需要的硫酸少、途径②无污染性气体产生,答案选②;(5)途径③的反应为浓硫酸和铜加热反应生成硫酸铜、二氧化硫和水,反应的化学反应方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;(6)配制1000mL 0.1mol/L的硫酸铜溶液,溶液中溶质物质的量=1L×0.1mol/L=0.1mol,则选用硫酸铜晶体物质的量为0.1mol,因此需要胆矾质量=250g/mol×0.1mol=25.0g。
CuSO4+SO2↑+2H2O;(6)配制1000mL 0.1mol/L的硫酸铜溶液,溶液中溶质物质的量=1L×0.1mol/L=0.1mol,则选用硫酸铜晶体物质的量为0.1mol,因此需要胆矾质量=250g/mol×0.1mol=25.0g。