题目内容
【题目】近几年全国各地都遭受“十面霾伏”。其中机动车尾气和燃煤产生的烟气对空气质量恶化“贡献”最大。汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g) ΔH <0。在t℃下,将2.0molNO、2.4molCO气体通入到容积固定的2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
2CO2(g) +N2(g) ΔH <0。在t℃下,将2.0molNO、2.4molCO气体通入到容积固定的2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:

(1)该反应平衡常数的表达式为________。
(2)20min时,c(CO2)为__________,NO的转化率为__________。
(3)0--10min的平均速率v(N2)=__________。
(4)20min时,若改变反应条件,导致CO转化率增大,则改变的条件可能为__(填序号)。
A.缩小容器容积 B.增加CO的量
C.降低温度 D.使用催化剂
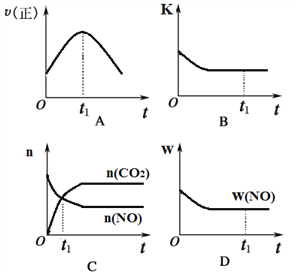
(5)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行t1时刻达到平衡状态的是_______(填代号)【下图中的v(正)、K、n、w分别代表正反应速率、平衡常数、物质的量、质量分数】
【答案】 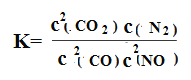 0.4 mol/L 40% 0.02mol/(L·min) AC BD
0.4 mol/L 40% 0.02mol/(L·min) AC BD
【解析】(1)根据方程式可知该反应平衡常数的表达式为 ;(2)20min时氮气浓度是0.2mol/L,则根据方程式可知c(CO2)为0.4mol/L,消耗NO是0.4mol/L,则NO的转化率为0.4/1.0×100%=40%;(3)0~10min的平均速率v(N2)=0.2mol/L÷10min=0.02mol/(L·min);(4)A、正反应体积减小,缩小容器容积压强增大,平衡正向移动,CO转化率增大,A正确;B、增加CO的量,CO转化率降低,B错误;C、正反应放热,降低温度,平衡正向移动,CO转化率增大,C正确;D、使用催化剂不影响平衡状态,转化率不变,D错误,答案选AC;(5)A、t1时正反应速率仍然在变化,说明没有达到平衡状态,A错误;B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,B正确;C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,C错误;D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,D正确;答案选BD。
;(2)20min时氮气浓度是0.2mol/L,则根据方程式可知c(CO2)为0.4mol/L,消耗NO是0.4mol/L,则NO的转化率为0.4/1.0×100%=40%;(3)0~10min的平均速率v(N2)=0.2mol/L÷10min=0.02mol/(L·min);(4)A、正反应体积减小,缩小容器容积压强增大,平衡正向移动,CO转化率增大,A正确;B、增加CO的量,CO转化率降低,B错误;C、正反应放热,降低温度,平衡正向移动,CO转化率增大,C正确;D、使用催化剂不影响平衡状态,转化率不变,D错误,答案选AC;(5)A、t1时正反应速率仍然在变化,说明没有达到平衡状态,A错误;B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,B正确;C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,C错误;D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,D正确;答案选BD。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案