题目内容
【题目】A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
(1)E在同期表中的位置是_______,其基态原子的简化电子排布式为____________。
(2)CB![]() 的立体构型是______。
的立体构型是______。
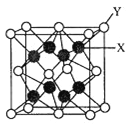
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为____(填离子符号);D2C的熔点比CaF2熔点__________________(填“高”、“低”或“无法比较”)。
【答案】第四周期VIII族 [Ar]3d64s2 三角锥型 S2- 低
【解析】
根据题目所述,A基态原子的核外电子占据4个原子轨道,只能为1s22s22p2,A为碳元素。大气平流层中单质B3浓度减少会致人患皮肤癌增加,故B元素为氧元素。D是前四周期元素中第一电离能最小的元素,同周期元素,从左到右,第一电离能逐渐增大,D元素为钾元素。E的合金是当今用量最大的合金,E为铁元素。又因为B、C为同主族元素,C只能为硫元素。结合物质结构知识解答。
(1)E在同期表中的位置是第四周期,VIII族,其基态原子的简化电子排布式为 [Ar]3d64s2。故答案为:第四周期VIII族;[Ar]3d64s2;
(2)CB![]() 为SO32-,中心原子为S,价层电子对数为4,含有一对孤电子对,硫原子采取sp3,杂化所以其立体构型是三角锥型。
为SO32-,中心原子为S,价层电子对数为4,含有一对孤电子对,硫原子采取sp3,杂化所以其立体构型是三角锥型。
故答案为:三角锥型;
(3)根据图中所示,晶胞计算后可知,Y:X=2:1,即Y为C,X为D元素。通过题目解析可知,C为硫元素,故Y应为S2-。D2C为K2S,与CaF2都为离子晶体,所以其熔点高低取决于化合物之间的离子键强度,离子键强度高,熔点高。离子键强度的决定因素:①.离子带电荷越大,离子键越强。②.离子半径越小,离子键越强。③.形成离子键两键结原子的电负性差较大者,离子键较强。这里CaF2的电负性差较大,故CaF2熔点高。
故答案为:S2-;低。

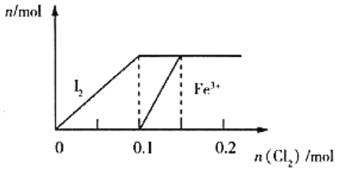
【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v=_________。
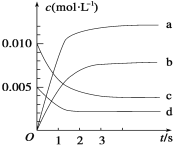
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂