题目内容
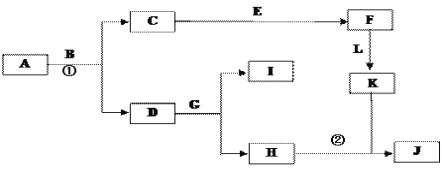
【题目】已知1 g物质完全燃烧时的反应热叫做该物质的热值。有以下能量转化图,下列说法不正确的是( )

A.转化Ⅰ的热化学方程式为:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
B.转化Ⅱ的热化学方程式为:2CO(g)+O2(g)=2CO2(g) ΔH=-565.8 kJ·mol-1
C.由C→CO的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-110.6 kJ·mol-1
D.CO的热值:ΔH=-10.1 kJ·g-1
【答案】C
【解析】
A.由题给物质能量转化图可得:转化Ⅰ是C→CO2,热化学方程式为:C(s)+O2(g)==CO2(g) ΔH=-393.5 kJ·mol-1,A正确;
B.转化Ⅱ是CO→CO2,热化学方程式为CO(g)+![]() O2(g)==CO2(g) ΔH=-282.9 kJ·mol-1,B正确;
O2(g)==CO2(g) ΔH=-282.9 kJ·mol-1,B正确;
C.C→CO的热化学方程式为:C(s)+![]() O2(g)==CO(g) ΔH=-(393.5 kJ·mol-1-282.9 kJ·mol-1)=-110.6 kJ·mol-1,即:2C(s)+O2(g)==2CO(g) ΔH=-221.2 kJ·mol-1,C错误;
O2(g)==CO(g) ΔH=-(393.5 kJ·mol-1-282.9 kJ·mol-1)=-110.6 kJ·mol-1,即:2C(s)+O2(g)==2CO(g) ΔH=-221.2 kJ·mol-1,C错误;
D.由热值的定义结合能量转化图可知,CO的热值:ΔH=-![]() =-10.1 kJ·g-1,D正确;
=-10.1 kJ·g-1,D正确;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二甲醚是一种重要的清洁燃料,也可替代氟氯昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=________________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)下列可以说明反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)已经达到平衡状态的是________________(填字母代号)。
CO2(g)+H2(g)已经达到平衡状态的是________________(填字母代号)。
A.单位时间内一个H-H键断裂的同时有两个H-O键断裂
B.H2O与CO2的浓度相等
C.温度和体积一定时,容器内的压强保持不变
D.条件一定时,混合气体的平均相对分子质量不再变化
E.温度和体积一定时,CO的浓度保持不变
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
若加入CH3OH后,经过10min反应达到平衡,此时c(CH3OH)=___________。