题目内容
实验室配制一定物质的量浓度的溶液,需经计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等步骤.现需配制0.2mol/L的CuSO4溶液500mL.
回答下列问题:
(1)用托盘天平称取CuSO4?5H2O晶体的质量是 g.
(2)将溶解并冷却后的溶液转移的过程中用到的玻璃仪器有 .
(3)定容时,加水至距刻度线1-2cm时改用胶头滴管滴加蒸馏水至 .
(4)下列情况会使所配溶液浓度偏低的是 .(填序号)
A.定容时俯视
B.未将洗涤烧杯后的溶液转移至容量瓶
C.加蒸馏水时,不慎超过了刻度线
D.砝码上沾有杂质(或者使用生锈的砝码)
E.容量瓶使用前未经干燥.
回答下列问题:
(1)用托盘天平称取CuSO4?5H2O晶体的质量是
(2)将溶解并冷却后的溶液转移的过程中用到的玻璃仪器有
(3)定容时,加水至距刻度线1-2cm时改用胶头滴管滴加蒸馏水至
(4)下列情况会使所配溶液浓度偏低的是
A.定容时俯视
B.未将洗涤烧杯后的溶液转移至容量瓶
C.加蒸馏水时,不慎超过了刻度线
D.砝码上沾有杂质(或者使用生锈的砝码)
E.容量瓶使用前未经干燥.
考点:溶液的配制
专题:实验题
分析:(1)根据0.2mol/L的CuSO4溶液500mL中含有溶质硫酸铜的物质的量计算出需要CuSO4?5H2O晶体的质量;
(2)根据溶解溶液需要使用烧杯、转移时需要沿着玻璃棒转移到500mL容量瓶中进行解答;
(3)根据配制500mL 0.2mol/L的硫酸铜溶液时正确的定容方法进行判断;
(4)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(2)根据溶解溶液需要使用烧杯、转移时需要沿着玻璃棒转移到500mL容量瓶中进行解答;
(3)根据配制500mL 0.2mol/L的硫酸铜溶液时正确的定容方法进行判断;
(4)根据c=
| n |
| V |
解答:
解:(1)500mL 0.2mol/L的硫酸铜溶液中含有溶质硫酸铜的物质的量为:0.2mol/L×0.5L=0.1mol,需要CuSO4?5H2O晶体的质量为:250g/mol×0.1mol=25.0g,
故答案为:25.0;
(2)溶解并冷却后的溶液转移的过程中用到的玻璃仪器有:盛放溶液的烧杯、引流作用的玻璃棒和500mL容量瓶,
故答案为:玻璃棒、烧杯、容量瓶;
(3)定容时,加水至距刻度线1-2cm时改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切,
故答案为:溶液的凹液面与刻度线相切;
(4)A.定容时俯视,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液浓度偏高,故A错误;
B.未将洗涤烧杯后的溶液转移至容量瓶,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B正确;
C.加蒸馏水时,不慎超过了刻度线,导致配制的溶液体积偏大,溶液浓度偏低,故C正确;
D.砝码上沾有杂质(或者使用生锈的砝码),导致称量的溶质的质量偏大,配制的溶液中溶质的物质的量偏大,配制结果偏高,故D错误;
E.容量瓶使用前未经干燥,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故E错误;
故答案为:BC.
故答案为:25.0;
(2)溶解并冷却后的溶液转移的过程中用到的玻璃仪器有:盛放溶液的烧杯、引流作用的玻璃棒和500mL容量瓶,
故答案为:玻璃棒、烧杯、容量瓶;
(3)定容时,加水至距刻度线1-2cm时改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切,
故答案为:溶液的凹液面与刻度线相切;
(4)A.定容时俯视,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液浓度偏高,故A错误;
B.未将洗涤烧杯后的溶液转移至容量瓶,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B正确;
C.加蒸馏水时,不慎超过了刻度线,导致配制的溶液体积偏大,溶液浓度偏低,故C正确;
D.砝码上沾有杂质(或者使用生锈的砝码),导致称量的溶质的质量偏大,配制的溶液中溶质的物质的量偏大,配制结果偏高,故D错误;
E.容量瓶使用前未经干燥,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故E错误;
故答案为:BC.
点评:本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,注意掌握配制一定浓度的溶液方法,明确误差分析的方,试题侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

练习册系列答案
相关题目
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5.X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物.下列说法错误的是( )
| A、X、Y、Z都是非金属元素 |
| B、X、Y的最高价氧化物所对应的水化物酸性X>Y |
| C、X、Y、Z的电负性大小顺序是Z>X>Y |
| D、由X、Y、Z三种元素可形成多种共价化合物 |
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A、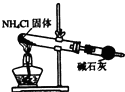 氨气发生装置 |
B、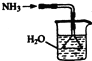 氨气吸收装置 |
C、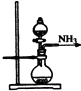 氨气发生装置 |
D、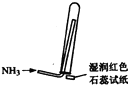 氨气收集、检验装置 |
某烃的一种同分异构体,核磁共振氢谱测得分子中只有一个吸收峰,则该烃的分子式可能为( )
| A、C15H32 |
| B、C16H34 |
| C、C17H36 |
| D、C18H38 |
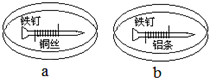 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )| A、a中铁钉附近呈现红色 |
| B、b中铝条附近有气泡产生 |
| C、a中铜丝上发生氧化反应 |
| D、b中铁钉上发生还原反应 |
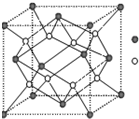 A-I为原子序数递增的前四周期的元素,已知A原子的最外层电子数是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属.H为应用最广泛的金属;I处于周期表中的第IIB族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前四周期的元素,已知A原子的最外层电子数是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属.H为应用最广泛的金属;I处于周期表中的第IIB族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)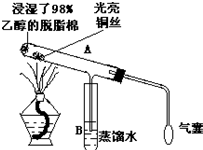 有关催化剂的催化机理等问题可从“乙醇催化氧化”实验得到一些认识,其实验装置如图:
有关催化剂的催化机理等问题可从“乙醇催化氧化”实验得到一些认识,其实验装置如图: (1)在蔗糖中加入浓H2SO4,反应的化学方程式为
(1)在蔗糖中加入浓H2SO4,反应的化学方程式为