题目内容
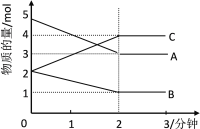
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
【答案】D
【解析】
试题分析:A.催化剂可同等程度的改变正、逆反应的反应速率,A错误;B.若在恒容条件下,向容器通入惰性气体,反应体系的压强变大,但反应各物质的浓度不变,反应速率也不变,B错误;C.不论反应是吸热反应还是放热反应,降低温度反应速率一定变慢,则达到平衡的时间将延长,C错误;D.根据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为v=![]() ,D正确;答案选D。
,D正确;答案选D。

【题目】I.已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:
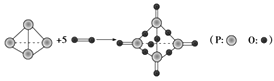
试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量_____kJ。
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
Ⅱ.化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是_________(填序号)。
A. 2FeBr2 + 3Cl2 = 2FeCl3+2Br2
B. Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C. 2H2O = 2H2↑+O2↑
D. Cu+2AgNO3 = 2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
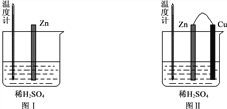
有关实验现象,下列说法正确的是:_____________(填序号)。
图Ⅰ中气泡产生在锌棒表面,Ⅱ中产生在铜棒表面
图Ⅰ和图Ⅱ的气泡均产生在锌棒表面
两图中生成气体的速率几乎一样快
图Ⅱ中产生气体的速度比Ⅰ快
温度计显示的均为室温
图Ⅱ中温度计的示数高于图Ⅰ的示数
图Ⅰ中温度计的示数高于图Ⅱ的示数
图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为____________________,一段时间后,负极增重48克,转移电子_______mol。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
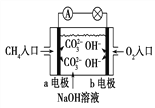
①电池的负极反应式为: ____________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。