题目内容
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是;2Cu2O+ Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为__________________;Cu2O与Cu2S比较,熔点较高的是_______,原因为_____________________________________。
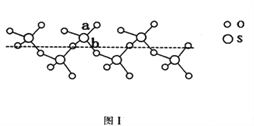
(2)SO2与SO3的键角相比,键角更大的是____________。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1所示。此固态SO3中S原子的杂化轨道类型是_______;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为_________(填图中字母)。
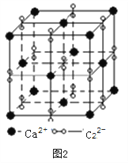
(3)离子化合物CaC2的一种晶体结构如下图2所示。写出该物质的电子式_____。从钙离子看,属于____________堆积;一个晶胞含有的π键平均有______个。

(4)奥氏体是碳溶解在γ—Fe中形成的一种间隙固溶体,无磁性,其晶胞如上图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为____________________ pm。(阿伏加德罗常数的值用NA表示,写出计算式即可)。
【答案】 ![]() Cu2O 两物质均为离子化合物,且离子所带电荷数相同,O2-半径小于S2-,所以Cu2O的晶格能大,熔点更高 SO3 sp3 a
Cu2O 两物质均为离子化合物,且离子所带电荷数相同,O2-半径小于S2-,所以Cu2O的晶格能大,熔点更高 SO3 sp3 a ![]() 面心立方 8 FeC
面心立方 8 FeC ![]()
【解析】(1)本题考查轨道式的表示、晶体熔沸点高低判断,Cu位于第四周期IB族,Cu+的价电子为第三层的d能级,根据泡利原理和洪特规则,Cu+价电子轨道式为![]() ;Cu2O和Cu2S都属于离子晶体,晶格能越大,晶体熔沸点越高,晶格能与半径、所带电荷数有关,半径越小、所带电荷数越多,晶格能越大,Cu2O和Cu2S所带电荷数相同,S2-的半径大于O2-的半径,因此Cu2S的沸点低于Cu2O;(2)本题考查杂化类型判断,SO2含有的孤电子对为(6-2×2)/2=1,SO3中含有孤电子对为(6-2×3)/2=0,孤电子对之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对之间斥力,因此SO3键角大于SO2键角,根据图1,S有4个σ键,无孤电子对,价层电子对数为4,杂化轨道数等于价层电子对数,即杂化类型为sp3;如图所示,a含有双键的成分,键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长,即较短的键为a;(3)本题考查晶胞,根据图2,CaC2的电子式为:
;Cu2O和Cu2S都属于离子晶体,晶格能越大,晶体熔沸点越高,晶格能与半径、所带电荷数有关,半径越小、所带电荷数越多,晶格能越大,Cu2O和Cu2S所带电荷数相同,S2-的半径大于O2-的半径,因此Cu2S的沸点低于Cu2O;(2)本题考查杂化类型判断,SO2含有的孤电子对为(6-2×2)/2=1,SO3中含有孤电子对为(6-2×3)/2=0,孤电子对之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对之间斥力,因此SO3键角大于SO2键角,根据图1,S有4个σ键,无孤电子对,价层电子对数为4,杂化轨道数等于价层电子对数,即杂化类型为sp3;如图所示,a含有双键的成分,键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长,即较短的键为a;(3)本题考查晶胞,根据图2,CaC2的电子式为:![]() ;根据晶胞的结构,Ca2+位于顶点和面心,因此属于面心立方堆积;C22-位于棱上和体心,属于晶胞的C22-的个数为12×1/4+1=4,根据CaC2的电子式,两个碳原子之间有3对电子对,即1个C22-有2个π键,即1个晶胞中有2×4=8个π键;(4)本题考查晶胞知识,根据图3,铁原子位于顶点、面心,个数为8×1/8+6×1/2=4,碳原子位于棱上和体心,个数为12×1/4+1=4,因此化学式为FeC,晶胞的质量为4×68/NAg,根据密度的定义,得出晶胞的边长为
;根据晶胞的结构,Ca2+位于顶点和面心,因此属于面心立方堆积;C22-位于棱上和体心,属于晶胞的C22-的个数为12×1/4+1=4,根据CaC2的电子式,两个碳原子之间有3对电子对,即1个C22-有2个π键,即1个晶胞中有2×4=8个π键;(4)本题考查晶胞知识,根据图3,铁原子位于顶点、面心,个数为8×1/8+6×1/2=4,碳原子位于棱上和体心,个数为12×1/4+1=4,因此化学式为FeC,晶胞的质量为4×68/NAg,根据密度的定义,得出晶胞的边长为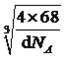 cm,根据晶胞的结构,两个最近的碳原子的距离是面对角线的一半,则两个最近的碳原子的距离是
cm,根据晶胞的结构,两个最近的碳原子的距离是面对角线的一半,则两个最近的碳原子的距离是![]() pm。
pm。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案