题目内容
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
已知:反应1 CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
反应2 2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
则该催化重整反应的△H=___kJmol-1。
(2)有科学家提出可利用FeO吸收CO2:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s),对该反应的描述正确的是__。
2Fe3O4(s)+C(s),对该反应的描述正确的是__。
A.增大FeO的投入量,利于平衡正向移动
B.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
D.恒温恒压下,气体摩尔质量不变可作为平衡的标志
E.若该反应的△H﹤0,则达到化学平衡后升高温度,CO2的物质的量会增加
(3)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
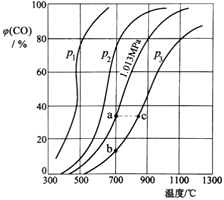
①图中p1、p2、p3的大小关系是______,图中a、b、c三点对应的平衡常数Ka、Kb、Kc的大小关系是______。
②900℃、1.013MPa时,1molCO2与足量碳反应达平衡后容器的体积为VL,CO2的转化率为___(保留一位小数),该反应的平衡常数K=___。
③将②中平衡体系温度降至640℃,压强降至0.1013MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
(4)在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO3-):c(CO32-)=4:1,此时溶液pH=______。(已知:室温下,H2CO3的k1=4×10-7,k2=5×10-11。lg2=0.3)
【答案】+247 CE p1<p2<p3 Ka=Kb<Kc 66.7% ![]() < 9.7
< 9.7
【解析】
(1)根据盖斯定律,将已知的两个热化学方程式叠加,可得催化重整的热化学方程式的反应热;
(2)根据化学平衡状态的特征及外界条件对化学平衡移动的影响分析判断;
(3)①反应C(s)+CO2(g)![]() 2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大;化学平衡常数只随温度的改变而改变;
2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大;化学平衡常数只随温度的改变而改变;
②900℃、1.013MPa时,平衡时CO的体积分数为80%,计算CO2转化的量,转化率就是转化的量与起始量比值的百分数,将各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
③根据改变条件前后CO2的体积分数的变化判断,根据反应商判断化学反应的方向;
(4)所得溶液c(HCO3-):c(CO32-)=4:1,根据K2= =5×10-11,计算c(H+),再根据pH=-lgc(H+)计算溶液pH。
=5×10-11,计算c(H+),再根据pH=-lgc(H+)计算溶液pH。
(1)①CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
②2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
根据盖斯定律,将热化学方程式①-②,整理可得:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+(75+172)kJ/mol=+247kJ/mol;
2CO(g)+2H2(g) △H=+(75+172)kJ/mol=+247kJ/mol;
(2) A.FeO是固体,增大FeO的投入量,不能使化学平衡发生移动,A错误;
B.该反应的正反应是气体体积减小的反应,压缩容器体积,即增大压强,化学平衡向气体体积减小的正反应方向移动,最终达到平衡时CO2的转化率增大,但平衡移动的趋势是微弱的,不能抵消。又由于压缩体积导致的物质的浓度增大,因此平衡时c(CO2)增大,B错误;
C.恒温恒容时,气体的质量是变量,容器的容积不变,气体的密度也为变量,若气体密度不变,则反应达到平衡状态,因此可作为平衡的标志,C正确;
D.反应混合物中只有CO2为气体,恒温恒压下,气体摩尔质量始终不变,因此不可作为平衡的标志,D错误;
E.若该反应的△H﹤0,则达到化学平衡后,若升高温度,化学平衡逆向移动,最终达到平衡时CO2的物质的量会增加,E正确;
故合理选项是CE;
(3)①反应C(s)+CO2(g)![]() 2CO(g)是气体体积增大的反应,随着反应进行,体系压强增大。减小压强有助于化学平衡正向移动,表明压强低时对应着的CO体积分数较高,则p1、p2、p3的大小关系是:p1<p2<p3;
2CO(g)是气体体积增大的反应,随着反应进行,体系压强增大。减小压强有助于化学平衡正向移动,表明压强低时对应着的CO体积分数较高,则p1、p2、p3的大小关系是:p1<p2<p3;
化学平衡常数只随温度的改变而改变,在压强不变时,升高温度,CO含量增大,说明升高温度,化学平衡正向移动,化学平衡常数增大,因此a、b、c三点对应的平衡常数大小关系是:Ka=Kb<Kc;
②900℃、1.013MPa时,设反应转化的CO2的物质的量为xmol,则平衡时n(CO)=2x,n(CO2)=1-x,根据图象可知平衡时CO的体积分数为80%,则![]() ×100%=80%,解得x=
×100%=80%,解得x=![]() ,所以CO2的转化率为:
,所以CO2的转化率为:![]() ×100%=66.7%;
×100%=66.7%;
平衡时各种气体的浓度,c(CO)=![]() ,c(CO2)=
,c(CO2)=![]() ,所以根据化学平衡常数的含义,可得此时反应的化学平衡常数K=
,所以根据化学平衡常数的含义,可得此时反应的化学平衡常数K= ;
;
③反应C(s)+CO2(g)![]() 2CO(g)的正反应是气体分子数增大的吸热反应,降低压强,升高温度均有利于反应正向进行,所以将②中平衡体系温度降至640℃,压强降至0.1013 MPa,降低温度减小压强,使正、逆反应速率均减小,重新达到平衡后CO2的体积分数为50%,设反应转化的CO2
2CO(g)的正反应是气体分子数增大的吸热反应,降低压强,升高温度均有利于反应正向进行,所以将②中平衡体系温度降至640℃,压强降至0.1013 MPa,降低温度减小压强,使正、逆反应速率均减小,重新达到平衡后CO2的体积分数为50%,设反应转化的CO2![]() =50%,解得y=
=50%,解得y=![]() mol<
mol<![]() mol,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,即化学平衡向逆反应方向移动,所以v(正)<v(逆);
mol,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,即化学平衡向逆反应方向移动,所以v(正)<v(逆);
(4)所得溶液c(HCO3-):c(CO32-)=4:1,由于K2= =5×10-11,则c(H+)=2.0×10-10,所以溶液的pH=-lgc(H+)=10-0.3=9.7。
=5×10-11,则c(H+)=2.0×10-10,所以溶液的pH=-lgc(H+)=10-0.3=9.7。

 名校课堂系列答案
名校课堂系列答案