题目内容
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
【答案】B
【解析】
A. 3He的中子数为3-2=1,则3g3He的中子数为3g÷3g/mol×NA/mol=1NA,故A正确;
B. 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1 L 0.1 mol·L1的磷酸钠溶液中磷酸根离子的个数小于1 L× 0.1 mol·L1×NA =0.1NA,故B错误;
C. 重铬酸钾被还原为铬离子时,铬元素从+6降低到+3。1mol重铬酸钾中含2molCr原子,故转移的电子数为1mol×2×3×NA/mol=6NA,故C正确;
D. 常温下,11g CO2所含的共用电子对数目为11g÷44g/mol×4×NA /mol= NA,故 D正确;
故选:B。

【题目】![]() 是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
已知反应:![]()
![]()
![]()
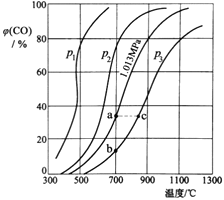
![]() 工业制取炭黑的方法之一是将甲烷隔绝空气加热到
工业制取炭黑的方法之一是将甲烷隔绝空气加热到![]() 进行裂解。该反应的热化学方程式为______。
进行裂解。该反应的热化学方程式为______。
![]() 容积固定为1L的密闭容器内充入
容积固定为1L的密闭容器内充入![]() 和
和![]() ,保持
,保持![]() 发生反应
发生反应![]() ,用压力计监测反应过程中容器内压强的变化如下表:
,用压力计监测反应过程中容器内压强的变化如下表:
反应时间 | 0 | 5 | 10 | 15 | 20 | 25 |
压强 |
|
|
|
|
|
|
则反应从开始到20min时,以CO浓度变化表示的平均反应速率![]() ______。
______。
![]() 对于反应
对于反应![]() 来说:
来说:
![]() 时,平衡常数
时,平衡常数![]() 。
。![]() 测得密闭容器中各物质达到平衡时物质的量浓度分别为:
测得密闭容器中各物质达到平衡时物质的量浓度分别为:![]() ,
,![]() ,
,![]() ,
,![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 下列措施有利于提高反应混合气中
下列措施有利于提高反应混合气中![]() 含量的是______。
含量的是______。
A.使用催化剂 ![]() 升高温度
升高温度 ![]() 及时导出CO
及时导出CO![]() 增大反应体系的压强
增大反应体系的压强
![]() 一定条件下,将
一定条件下,将![]() 与
与![]() 按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
A.![]()
![]()
B.体系中混合气体密度不变
C.![]() 与
与![]() 的转化率相等
的转化率相等
D.![]() 与
与![]() 物质的量之比不再改变
物质的量之比不再改变
E.反应体系压强不再改变
![]() 以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
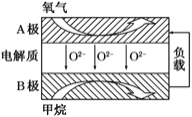
![]() 极上的电极反应式为______。
极上的电极反应式为______。
![]() 以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到
以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到![]() 标准状况
标准状况![]() 气体时,消耗甲烷的体积为______
气体时,消耗甲烷的体积为______![]() 标准状况
标准状况![]() 。
。