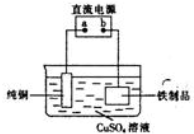
题目内容
5.正常人血液中的钙含量约为10mg%(mg%为毫克百分浓度,即每100mL溶液中,所含溶质的毫克数).取某病人血液10.00mL,测其钙含量,稀释后加入足量(NH4)2C2O4溶液,使血液中钙生成CaC2O4沉淀,过滤,将该沉淀溶解于H2SO4中,然后用0.1000mol/L KMnO4溶液氧化,用去KMnO4溶液5.00mL.
请配平方程式并计算:
(1)5H2C2O4+2KMnO4+3H2SO4→1K2SO4+2MnSO4+10CO2↑+8H2O
(2)计算正常人血液中钙的物质的量浓度0.125mol/L;
(3)计算此病人血液中钙的毫克百分浓度500mg%.
分析 (1)该反应中C元素化合价由+3价变为+4价、Mn元素化合价由+7价变为+2价,根据转移电子守恒、原子守恒配平方程式;
(2)根据5 H2C2O4+2 KMnO4+3 H2SO4=1 K2SO4+2 MnSO4+10 CO2↑+8 H2O计算草酸的物质的量,根据草酸与草酸钙的关系式计算钙离子物质的量,从而计算草酸钙物质的量浓度;
(3)先计算10mL血液中钙离子质量,再计算100mL血液中钙离子质量.
解答 解:(1)该反应中C元素化合价由+3价变为+4价、Mn元素化合价由+7价变为+2价,根据转移电子守恒、原子守恒配平方程式为5 H2C2O4+2 KMnO4+3 H2SO4=1 K2SO4+2 MnSO4+10 CO2↑+8 H2O,
故答案为:5;2;3;1;2;10;8;
(2)根据5 H2C2O4+2 KMnO4+3 H2SO4=1 K2SO4+2 MnSO4+10 CO2↑+8 H2O中高锰酸钾和草酸的关系式得n(H2C2O4)=$\frac{0.1000mol/L×0.005L}{2}×5$=0.00125mol,根据CaC2O4得n(H2C2O4)=
n(CaC2O4)=n(Ca 2+)=0.00125mol,c(Ca 2+)=$\frac{0.00125mol}{0.01L}$=0.125mol/L,
故答案为:0.125mol/L;
(3)10mL血液中m(Ca 2+)=0.00125mol×40g/mol=50mg,则100mL血液中含有500mg钙离子,所以其毫克百分浓度为500mg%,故答案为:500mg%.
点评 本题考查方程式的配平及方程式的有关计算,利用原子守恒、转移电子守恒配平方程式,明确各个物理量之间的关系式是解本题关键,题目难度不大.

| A. | H2、D2和T2互称为同素异形体 | B. | 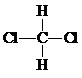 和 和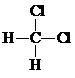 互称为同分异构体 互称为同分异构体 | ||
| C. | 35Cl和37Cl 互称为同位素 | D. | C2H4与C4H8一定能互称为同系物 |
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液量碱性,只能与酸反应 | |
| B. | 乙与氧气的摩尔质量相同,则乙可能含极性键和非极性键 | |
| C. | 丙中含有第二周期IVA族元素,则丙一定是甲烷的同系物 | |
| D. | 丁和甲中各元素质量比相同,则丁中含有-2价的元素 |
| A. | 酸性高锰酸钾与少量双氧水反应:2MnO4-+3H2O2+6H+═2Mn2++3O2↑+6H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 向NaClO溶液中通入过量CO2;CO2+ClO-+H2O═HCO3-+HClO |
| A. | ③⑤⑥ | B. | ①③⑥ | C. | ②④⑥ | D. | ①③⑤ |
①
 △H=-116kJ•mol-1
△H=-116kJ•mol-1②
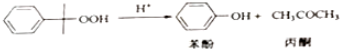 △H=-253k•mol-1
△H=-253k•mol-1
相关化合物的物理常数:
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
(2)反应①和②分别在装置A和C中进行(填装置符号).
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(4)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(5)中和釜D中加入的Z最适宜的是c(填编号)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
| A. | 2,2─二甲基戊烷 | B. | 3,4─二甲基辛烷 | C. | 2-甲基-3-丁炔 | D. | 1,3─丁二烯 |

 );下列试剂能与甲反应而褪色的是AC(填标号)
);下列试剂能与甲反应而褪色的是AC(填标号) .
.