题目内容
13.甲、乙、丙、丁4种物质分别含有2种或3种元素,它们的分子中各含18个电子,甲是气态氢化物,在水中分步电离出的两种阴离子,下列推断合理的是( )| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液量碱性,只能与酸反应 | |
| B. | 乙与氧气的摩尔质量相同,则乙可能含极性键和非极性键 | |
| C. | 丙中含有第二周期IVA族元素,则丙一定是甲烷的同系物 | |
| D. | 丁和甲中各元素质量比相同,则丁中含有-2价的元素 |
分析 甲是18电子的气态氢化物,在水中分步电离出两种阴离子,则其水溶液为二元弱酸,不难得出甲为H2S.
A.某钠盐溶液含甲电离出的阴离子,该盐为Na2S或NaHS;
B.乙与氧气的摩尔质量相同,可能为CH3 OH、N2H4等;
C.丙中含有二周期IVA族的元素,可能为CH3 OH等;
D.丁和甲中各元素质量比相同,丁应为H2O2.
解答 解:甲是18电子的气态氢化物,在水中分步电离出两种阴离子,则其水溶液为二元弱酸,不难得出甲为H2S.
A.某钠盐溶液含甲电离出的阴离子,该盐为Na2S或NaHS,NaHS既能与盐酸等反应生成H2S,也能与NaOH反应生成Na2S,故A错误;
B.氧气的摩尔质量为32g/mol,乙的摩尔质量也为32g/mol,且含有18电子,CH3 OH、N2H4符合,N2H4中含有极性键、非极性键,故B正确;
C.第二周期IVA族元素为C,如CH3OH符合,但CH3OH不是CH4的同系物,故C错误;
D.H2S中元素的质量比为1:16,H2O2分子中元素的质量比也为1:16,H2O2中没有-2价元素,故D错误.
故选:B.
点评 本题考查无机物的推断,题目难度较大,注意常见18电子物质的种类以及性质,解答本题时注意能找出反例.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.环境问题是全球共同关注的问题,环境污染的发生、危害与防治都与化学有关.根据有关的化学知识,下列说法正确的是( )
| A. | 严禁排放未经处理的有毒工业废水--防止水土流失 | |
| B. | 不允许焚烧农作物秸秆--防止温室效应 | |
| C. | 限制生产含磷洗涤剂--防止江河、湖泊出现“赤潮” | |
| D. | 限制生产不符合尾气排放标准的汽车--防止氮的氧化物及一氧化碳等污染空气 |
4.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能酸性高锰酸钾溶液褪色 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应为可逆反应 |
1.从海水中提取镁,可按照如下步骤进行:
①把贝壳制成石灰乳;②在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将所得产物熔融后电解.关于提取镁,
下列说法不正确的是( )
①把贝壳制成石灰乳;②在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将所得产物熔融后电解.关于提取镁,
下列说法不正确的是( )
| A. | 此法的优点之一是原料丰富 | |
| B. | 进行①②③步操作的目的是从海水中富集氯化镁 | |
| C. | 第④步电解时会产生氯气 | |
| D. | 以上过程中涉及的反应有分解反应、化合反应、复分解反应和置换反应 |
8.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
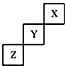

| A. | Y的单质的熔点比Z的低 | |
| B. | Y的最高正化合价为+5 | |
| C. | Z的氢化物的稳定性比Y的强 | |
| D. | X、Y、Z三种元素中,单质在常温下均为气态 |
18.在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g)?2NO2(g)△H<0,其中NO为无色气体,NO2为红棕色气体.不能作为达到化学平衡状态标志的是( )
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 混合气体颜色深浅保持不变 | |
| C. | 反应器中压强不随时间变化而变化 | |
| D. | 混合气体平均相对分子质量保持不变 |
3.下列离子方程式正确的是( )
| A. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 氯气通入水中:C12+H2O═2H++C1-+C1O- | |
| D. | 亚硫酸钡与稀硝酸反应:BaSO3+2H+═Ba2++SO2↑+H2O |
