题目内容
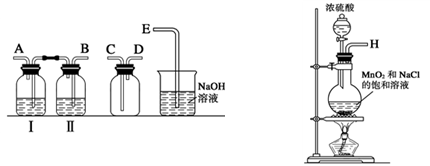
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。
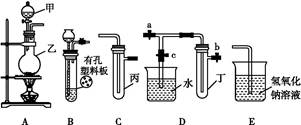
请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。

请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
(1)H2、CO2等
(2)①实验Ⅰ结论不合理,因为未进行干燥的Cl2是否能使品红褪色实验,即使品红褪色的不一定是氯气与水反应的产物,也可能是未反应的氯气。实验Ⅱ结论不合理,制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡 ②在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液;烧瓶中有黄绿色气体生成,丙试管中溶液由无色变为橙色;可证明Cl2的氧化性强于Br2,则Br-的还原性强于Cl-
(3)①Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O
②a、b c 双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁中
③0.045 mol·L-1
(2)①实验Ⅰ结论不合理,因为未进行干燥的Cl2是否能使品红褪色实验,即使品红褪色的不一定是氯气与水反应的产物,也可能是未反应的氯气。实验Ⅱ结论不合理,制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡 ②在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液;烧瓶中有黄绿色气体生成,丙试管中溶液由无色变为橙色;可证明Cl2的氧化性强于Br2,则Br-的还原性强于Cl-
(3)①Cu+4HNO3(浓)
 Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O ②a、b c 双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁中
③0.045 mol·L-1
(1)B装置用于块状不溶于水的固体与液体反应制取气体,故可用锌粒与稀H2SO4制H2,也可用大理石与盐酸制CO2等。
(2)①未反应的Cl2及氯气与水反应的产物都有可能使品红溶液褪色,故结论Ⅰ不合理。A装置制取Cl2使用的浓盐酸具有挥发性,会与NaHCO3反应产生CO2气泡,故实验Ⅱ的结论不合理。②利用氧化性Cl2>Br2即可证明,可在丙中放NaBr溶液,将制得的Cl2通入NaBr溶液,发现溶液由无色变为橙色可证明。
(3)铜与浓HNO3反应放出NO2,收集于试管丁中然后用微热法使NO2与水接触从而使水倒流于丁中。根据1 mol NO2转化成1 mol HNO3可知,所得HNO3的浓度为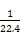 mol/L,即0.045 mol/L。
mol/L,即0.045 mol/L。
(2)①未反应的Cl2及氯气与水反应的产物都有可能使品红溶液褪色,故结论Ⅰ不合理。A装置制取Cl2使用的浓盐酸具有挥发性,会与NaHCO3反应产生CO2气泡,故实验Ⅱ的结论不合理。②利用氧化性Cl2>Br2即可证明,可在丙中放NaBr溶液,将制得的Cl2通入NaBr溶液,发现溶液由无色变为橙色可证明。
(3)铜与浓HNO3反应放出NO2,收集于试管丁中然后用微热法使NO2与水接触从而使水倒流于丁中。根据1 mol NO2转化成1 mol HNO3可知,所得HNO3的浓度为
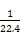 mol/L,即0.045 mol/L。
mol/L,即0.045 mol/L。
练习册系列答案
相关题目
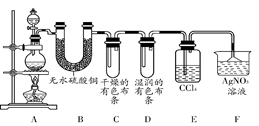

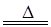 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。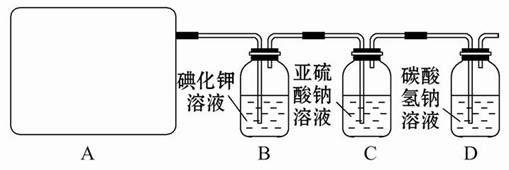
 Cu(NO3)2
Cu(NO3)2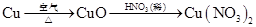
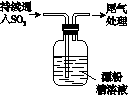
 的方法是: 。
的方法是: 。