题目内容
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有_______性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有_______性。
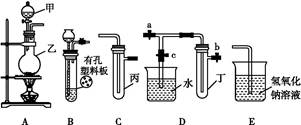
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是_______ (填序号)。
①Cu+HNO3(浓) Cu(NO3)2
Cu(NO3)2
②Cu+HNO3(稀) Cu(NO3)2
Cu(NO3)2
③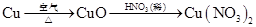
(3)①在100 mL 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是_______
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式______________________________。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为__________________________________________。
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有_______性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有_______性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是_______ (填序号)。
①Cu+HNO3(浓)
 Cu(NO3)2
Cu(NO3)2②Cu+HNO3(稀)
 Cu(NO3)2
Cu(NO3)2③
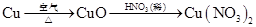
(3)①在100 mL 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是_______
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为__________________________________________。
(1)强氧化 脱水 (2)③
(3)①D ②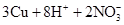 =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
(4)Cu+2HCl+H2O2=CuCl2+2H2O
(3)①D ②
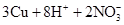 =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O(4)Cu+2HCl+H2O2=CuCl2+2H2O
(1)浓硫酸与铁、铝反应形成致密的氧化膜,表现了浓硫酸的强氧化性,浓硫酸使纸变黑表现了浓硫酸的脱水性。
(2)绿色化学思想是从源头上消除污染,①反应会产生NO2,②反应会产生NO,③反应不产生污染物,原子利用率最高,符合绿色化学思想。
(3)①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,n(H2SO4)="18" mol/L×0.1 L=
CuSO4+SO2↑+2H2O,n(H2SO4)="18" mol/L×0.1 L=
1.8 mol,假设1.8 mol完全反应,生成SO2 0.9 mol,在标准状况下的体积为0.9 mol×22.4 L/mol="20.16" L,实际上浓硫酸变成稀硫酸后反应就停止了,生成的SO2的体积小于20.16 L,故选D。
②NaNO3提供的 与硫酸提供的H+将铜氧化,离子方程式为
与硫酸提供的H+将铜氧化,离子方程式为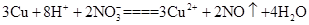
(4)根据信息可写出化学方程式为Cu+2HCl+H2O2=CuCl2+2H2O
(2)绿色化学思想是从源头上消除污染,①反应会产生NO2,②反应会产生NO,③反应不产生污染物,原子利用率最高,符合绿色化学思想。
(3)①Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O,n(H2SO4)="18" mol/L×0.1 L=
CuSO4+SO2↑+2H2O,n(H2SO4)="18" mol/L×0.1 L=1.8 mol,假设1.8 mol完全反应,生成SO2 0.9 mol,在标准状况下的体积为0.9 mol×22.4 L/mol="20.16" L,实际上浓硫酸变成稀硫酸后反应就停止了,生成的SO2的体积小于20.16 L,故选D。
②NaNO3提供的
 与硫酸提供的H+将铜氧化,离子方程式为
与硫酸提供的H+将铜氧化,离子方程式为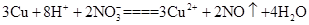
(4)根据信息可写出化学方程式为Cu+2HCl+H2O2=CuCl2+2H2O

练习册系列答案
相关题目