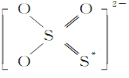题目内容
【题目】(1)铁元素的原子结构示意图为________;它在周期表中的位置是_________。
(2)某炼铜反应为:![]() 上述反应中,氧化剂是________;若反应中转移15 mol电子,则氧化产物的质量为___________。
上述反应中,氧化剂是________;若反应中转移15 mol电子,则氧化产物的质量为___________。
(3)氧和硫分别形成的氢化物中比较稳定的是________(写电子式)。
(4)与明矾相似,![]() 也可用作净水剂,其净水的原理是_________。
也可用作净水剂,其净水的原理是_________。
(5)![]() 又称摩尔盐,它可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的有色阳离子:_________________。
又称摩尔盐,它可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的有色阳离子:_________________。
【答案】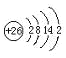 第四周期第VIII族
第四周期第VIII族 ![]() 、
、![]() 160 g
160 g ![]() 铁离子水解生成的氢氧化铁胶体具有吸附性 取少量样品溶于水,加KSCN溶液不变色,然后滴加氯水,溶液变为血红色,则含有亚铁离子
铁离子水解生成的氢氧化铁胶体具有吸附性 取少量样品溶于水,加KSCN溶液不变色,然后滴加氯水,溶液变为血红色,则含有亚铁离子
【解析】
(1)Fe的原子序数为26,有4个电子层,最外层电子数为2;
(2)在![]() 中,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价;
中,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价;
(3)非金属性O>S,则水稳定;
(4)铁离子水解生成胶体;
(5)检验亚铁离子可利用KSCN溶液和氯水,据此解答。
(1)Fe的原子序数为26,有4个电子层,最外层电子数为2,其原子结构示意图为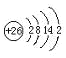 ;其位于元素周期表中的第四周期第VIII族;
;其位于元素周期表中的第四周期第VIII族;
故答案为: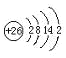 ;第四周期第VIII族;
;第四周期第VIII族;
(2)在![]() 中,Cu元素的化合价由+1价降低为0,S元素的化合价由2价升高为+4价,则氧化剂为Cu2S、Cu2O,氧化产物为SO2,当生成1mol SO2时,该反应转移6mol电子,则反应中转移15mol电子时,氧化产物SO2的质量为
中,Cu元素的化合价由+1价降低为0,S元素的化合价由2价升高为+4价,则氧化剂为Cu2S、Cu2O,氧化产物为SO2,当生成1mol SO2时,该反应转移6mol电子,则反应中转移15mol电子时,氧化产物SO2的质量为![]() ;
;
故答案为:![]() 、
、![]() ;160 g;
;160 g;
(3)非金属性越强,其氢化物越稳定,而非金属性O>S,则水较稳定,水的电子式为,![]() ;
;
故答案为:![]() ;
;
(4)铁离子水解生成氢氧化铁胶体,具有吸附性,可净化水;
故答案为:铁离子水解生成的氢氧化铁胶体具有吸附性;
(5)该摩尔盐中的有色阳离子为亚铁离子,检验亚铁离子可利用KSCN溶液和氯水,实验方法为:取少量样品溶于水,加KSCN溶液不变色,然后滴加氯水,溶液变为血红色,则含有亚铁离子。
故答案为:取少量样品溶于水,加KSCN溶液不变色,然后滴加氯水,溶液变为血红色,则含有亚铁离子。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案