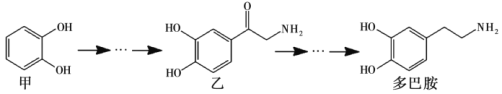
题目内容
【题目】可逆反应2A+3B![]() 2C+D,(A、B、C、D都为气体)在四种不同条件下的反应速率分别如下,则该反应在不同条件下反应速率最快的是( )
2C+D,(A、B、C、D都为气体)在四种不同条件下的反应速率分别如下,则该反应在不同条件下反应速率最快的是( )
A.v(A)=0.5mol/ (L·min)B.v(B)=0.6mol/ (L·min)
C.v(C)=0.35mol/ (L·min)D.v(D)=0.4mol/ (L·min)
【答案】D
【解析】
在相同条件下,同一反应中不同物质表示的反应速率数值可能不同,所以要比较同一反应在同一条件下反应速率的快慢,应利用不同物质表示的反应速率之比等于其化学计量数之比转化为同一物质表示的反应速率,再比较数值的大小。
将不同物质表示的速率都转化为A物质表示的反应速率,得如下结果:
A. v(A)=0.5mol/ (L·min),
B. v(B)=0.6mol/ (L·min),得v(A)=0.4mol/ (L·min)
C. v(C)=0.35mol/ (L·min) ,得v(A)=0.35mol/ (L·min)
D. v(D)=0.4mol/ (L·min) ,得v(A)=0.8mol/ (L·min)
通过比较可以看出,D中A表示的反应速率最快;
故选D。

练习册系列答案
相关题目