题目内容
【题目】碘化钠在医疗及食品方面有重要作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4·H2O+NaCl+Na2CO3
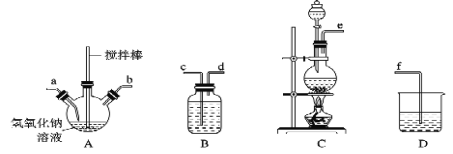
①制备次氯酸钠和氢氧化钠混合液装置的连接顺序为 ________________(按气流方向用小写字母表示)。
②若该实验温度控制不当,反应后测得三颈烧瓶内ClO-与ClO3-的物质的量之比为1:5,则Cl2与NaOH反应时,被氧化的氯元素与被还原的氯元素物质的量之比为_______________。
③制备水合肼时,应将_____________________滴到 ________________中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
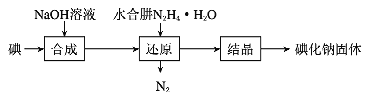
在“还原”过程中,主要消耗反应过程中生成的副产物IO![]() ,该过程的化学方程式为 _______________________________________________。
,该过程的化学方程式为 _______________________________________________。
工业上也可用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是 ___________________________________________________________________________________。
(3)测定产品中碘化钠含量的实验步骤
a、称取10.00g样品并溶解,在250mL容量瓶中定容;
b、量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后再加入X溶液作指示剂;
c、用0.2100mol·L-1的Na2S2O3标准液滴定至终点(2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准液体积为15.00mL。
①S2O![]() 的结构式如图所示,其中S*的化合价为____________。
的结构式如图所示,其中S*的化合价为____________。
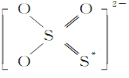
②X溶液为 ___________ ;滴定终点的现象为 __________________。
③该样品中NaI的质量分数为_________。
【答案】ecdabf 3:13 NaClO溶液 尿素溶液 2NaIO3+3N2H4·H2O=3N2↑+2NaI+9H2O 水合肼被氧化后的产物为N2和H2O,不引入杂质 0 淀粉(溶液) 滴入最后一滴Na2S2O3标准液,溶液由蓝色变为无色,且半分钟内不恢复 47.25%
【解析】
(1)根据实验原理及实验装置分析解答;根据氧化还原反应原理分析解答;(2)根据制备流程图分析反应原理,书写化学方程式;(3)根据滴定原理分析指示剂并计算样品的质量分数。
(1)①装置c由二氧化锰和浓盐酸制备氯气,用B装置的饱和食盐水除去HCl气体,为保证除杂充分,导气管长进短出,氯气与NaOH在A中反应制备,为充分反应,从a进去,由D装置吸收未反应的氯气,防止污染空气,故导气管连接顺序为:ecdabf;
②三颈瓶内ClO-与ClO3-的物质的量之比为1:5,设ClO-与ClO3-的物质的量分别为1mol、5mol,根据得失电子守恒,生成1molClO-则会生成Cl-1mol,生成5mol ClO3-则会生成Cl-25mol,则被氧化的氯元素为化合价升高的氯元素,物质的量之比为ClO-与ClO3-共1mol+5mol=6mol,被还原的氯元素为化合价降低的氯元素,即为Cl-,有1mol+25mol=26mol,故被氧化的氯元素与被还原的氯元素物质的量之比为6:26=3:13;
③将尿素滴到NaClO溶液中或过快滴加,都会使过量的NaClO溶液氧化水合肼,降低产率,故实验中取适量NaClO溶液逐滴加入到定量的尿素溶液中制备水合肼,滴加顺序不能颠倒,且滴加速度不能过快,防止水合肼被氧化;
(2)根据流程可知,副产物IO3-与水合肼生成NaI和氮气,反应为:2NaIO3+3N2H4·H2O=3N2↑+2NaI+9H2O;N2H4H2O被氧化后的产物为N2和H2O,不引入杂质,水合肼还原法制得的产品纯度更高;
(3) ①根据S2O![]() 的结构式可知,S的平均化合价为+2,中心S的化合价为+4价,S*的化合价为0价;
的结构式可知,S的平均化合价为+2,中心S的化合价为+4价,S*的化合价为0价;
②实验中滴定碘单质,用淀粉做指示剂,即X为淀粉;滴定终点的现象为滴入最后一滴Na2S2O3标准液,溶液由蓝色变为无色,且半分钟内不恢复;
③根据碘元素守恒,可得关系式:2I-~I2~2Na2S2O3,则n(NaI)=n(Na2S2O3),故样品中NaI的物质的量为:0.2100mol/L×0.015L×10=0.0315 mol, NaI的质量为:0.0315 mol×150g/mol=4.725g,故其质量分数为![]() ×100%=47.25%。
×100%=47.25%。