题目内容
20.短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大.在周期表中,A的原子半径最小.B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D与F形成的化合物DF是常用的调味品.试根据以上叙述回答:(1)元素名称:A氢、B碳、C氧.
(2)E在元素周期表中的位置:第三周期第ⅥA族.
(3)F离子结构示意图:
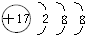 .
.(4)A、B组成的最简单化合物的名称是甲烷.
(5)C、D按原子个数比1:1组成的一种化合物与水发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(6)能说明E的非金属性比F的非金属性弱(填“强”或“弱”)的事实是氯气能从硫化钠溶液中置换出硫(举一例).
分析 短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大,在周期表中,A的原子半径最小,则A为氢元素,B元素的原子最外层电子数是内层电子数的两倍,则B为碳元素,C为地壳中含量最多的元素,则C为氧元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,则D为钠元素,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物,则E为硫元素,D与F形成的化合物DF是常用的调味品,则F为氯元素,据此答题.
解答 解:短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大,在周期表中,A的原子半径最小,则A为氢元素,B元素的原子最外层电子数是内层电子数的两倍,则B为碳元素,C为地壳中含量最多的元素,则C为氧元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,则D为钠元素,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物,则E为硫元素,D与F形成的化合物DF是常用的调味品,则F为氯元素,
(1)根据上面的分析可知,A为氢元素,B为碳元素,C为氧元素,故答案为:氢;碳;氧;
(2)E为硫元素,E在元素周期表中的位置第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(3)F为氯元素,F离子结构示意图为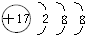 ,故答案为:
,故答案为: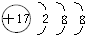 ;
;
(4)A为氢元素,B为碳元素,A、B组成的最简单化合物的名称是甲烷,故答案为:甲烷;
(5)C、D按原子个数比1:1组成的一种化合物为过氧化钠,其与水发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(6)E为硫元素,F为氯元素,根据元素周期律硫的非金属性弱于氯,能说明这一事实的是氯气能从硫化钠溶液中置换出硫,
故答案为:弱;氯气能从硫化钠溶液中置换出硫.
点评 本题考查结构性质位置关系应用,难度不大,明确元素种类是解题关键,注意掌握金属性、非金属性强弱比较实验事实,有利于基础知识的巩固.

(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.50mol•L-1NaOH溶液、0.55mol•L-1盐酸,实验尚缺少的玻璃仪器是量筒和温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否).
(3)他们记录的实验数据如下:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.50 mol•L-1 NaOH溶液 | 50 mL 0.55 mol•L-1 HCl溶液 | 20℃ | 23.2℃ | |
| ② | 50 mL 0.50 mol•L-1 NaOH溶液 | 50 mL 0.55 mol•L-1 HCl溶液 | 20℃ | 23.4℃ | |
①通过计算得到中和热△H=-55.2kJ/mol(保留一位小数).
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-55.2kJ/mol.
(4)若用0.60mol•L-1NaOH溶液代替0.50mol•L-1NaOH溶液做实验,对测定结果无(填“有”或“无”,下同)影响;若用0.55mol•L-1醋酸代替0.55mol•L-1盐酸做实验,对测定结果有影响.
(5)计算结果发现本次实验测定值与正确值57.3kJ/mol有偏差,产生偏差的原因可能是②③(填序号)操作:
①量取NaOH溶液的体积时仰视读数
②用温度计测定NaOH溶液的温度后直接测定盐酸的温度
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
| A. | 加水稀释10倍后,溶液的pH=4 | |
| B. | c(SO32-)+c(OH-)=c(H2SO3)+c(HSO3-) | |
| C. | 2c(SO32-)+c(HSO3-)+c(H2SO3)=0.02mol•L-1 | |
| D. | $\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$约为5×10-5 mol•L-1 |
| A. | AlCl3溶液和Al2(SO4)3溶液加热蒸干,灼烧都得到Al2O3 | |
| B. | 25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Ksp大小顺序为:盐酸>氯化铵>蒸馏水 | |
| C. | 已知25℃时,NH4F溶液显酸性,则电离常数K(NH3•H2O)<K(HF) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合溶液中,c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
| A. | 向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失 | |
| B. | 向Na2CO3饱和溶液中通入CO2溶液变浑浊,继续通入CO2,有晶体析出 | |
| C. | 向Ca(ClO)2溶液中通入CO2溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊 |
| A. | 放热反应 | B. | 熵增加的反应 | ||
| C. | 熵增加的吸热反应 | D. | 熵增加的放热反应 |
| A. | A<B<C<D | B. | D<A<B=C | C. | A=D<B=C | D. | D<A<B<C |
①
 ②
②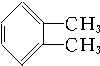 ③
③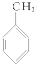 ④
④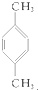
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |