题目内容
7.下列说法正确的是( )| A. | 只有活泼金属与活泼非金属元素原子之间才能形成离子键 | |
| B. | Na2O2中阳离子和阴离子个数比为1:1 | |
| C. | 形成离子键的阴、阳离子间只有静电吸引力 | |
| D. | 共价键存在于共价化合物中,也可能存在于单质及离子化合物中 |
分析 A、非金属元素之间也可以形成离子键,如氯化铵中铵根离子与氯离子之间;
B、Na2O2由钠离子与过氧根离子(O22-)构成;
C、形成离子键的阴阳离子之间存在静电作用;
D、共价化合物、单质中含有共价键,离子化合物中可能含有共价键.
解答 解:A、非金属元素之间也可以形成离子键,如氯化铵中铵根离子与氯离子之间,所以不一定只有金属元素和非金属元素才能形成离子键,故A错误;
B、Na2O2由钠离子与过氧根离子(O22-)构成,阳离子和阴离子个数比为2:1,故B错误;
C、形成离子键的阴、阳离子间既有吸引力,又有排斥力,故C错误;
D、共价键存在于共价化合物中,也可能存在于单质及离子化合物中,故D正确;
故选D.
点评 本题主要考查了离子键、共价键与离子化合物、共价化合物的关系,物质的构成,侧重考查学生对这几个概念的辨别能力,需要注意的是离子化合物中可能含共价键.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
17.下列说法或表示方法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(s,石墨)=C(s,金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 |
18.下列说法正确的是( )
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol | |
| B. | 500℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g)?2NH2(g)△H=-38.6 kJ•mol | |
| C. | 一定条件下,反应 N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol降低温度将向正反应方向移动 | |
| D. | 已知 2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
15. 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| B. | HB的电离方程式为HB=H++B- | |
| C. | NaA的水溶液中,离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
2.8月12日天津港发生爆炸,专家对爆炸事故原因猜测认为硝化棉或者硫化钠自燃是最可能的点火源,因此化学药品的安全存放是非常重要的.下列有关化学药品的存放说法不正确的是( )
| A. | 液溴易挥发,应用水液封并放在冷暗处保存 | |
| B. | 金属钠遇到氧气立即反应,应保存在煤油中或者液体石蜡里 | |
| C. | 硝酸见光易分解,应用棕色广口试剂瓶保存 | |
| D. | 碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存 |
12.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素 代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半 径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | G元素的单质不存在同素异形体 | |
| B. | I在DB2中燃烧生成两种化合物 | |
| C. | A的单质能将E单质从HE3的溶液中置换出来 | |
| D. | A、H、J的离子半径由大到小顺序是A>J>H |
16.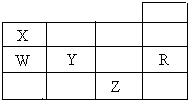 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | X、Y、Z的阴离子电子层结构均与R原子的相同 | |
| B. | 常压下,Y单质的沸点比Z单质的沸点高 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性强 | |
| D. | 最高价氧化物的水化物酸性W比Y强 |
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 14g 乙烯和丁烯的混合物中含有3NA对共用电子对 | |
| B. | 1mol苯中含有3NA个碳碳双键 | |
| C. | 乙烷与Cl2在光照下反应,每有NA个氢原子被氯替代,需消耗标准状况下Cl2 11.2L | |
| D. | 标准状况下,22.4L己烷中的碳原子数为6NA |