题目内容
10.如表各组物质中,不能按(“→”表示一步完成)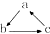 关系相互转化的是( )
关系相互转化的是( )| 选项 | A | B | C | D |
| a | Fe | SiO2 | Al(OH)3 | HNO3 |
| b | FeCl3 | Na2SiO3 | NaAlO2 | NO |
| c | FeCl2 | H2SiO3 | Al2O3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据物质的性质判断反应能否发生,C中Al2O3不能与水反应生成Al(OH)3.
解答 解:A、Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2$\stackrel{Zn}{→}$Fe,可以一步实现,故A不符合;
B、SiO2$\stackrel{NaOH}{→}$Na2SiO3 $\stackrel{HCl}{→}$H2SiO3$\stackrel{△}{→}$SiO2,故B不符合;
C、Al(OH)3$\stackrel{NaOH}{→}$NaAlO2,不能一步实现生成Al2O3,Al2O3不能一步实现生成Al(OH)3,故C符合;
D、HNO3$\stackrel{Cu}{→}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3,故D不符合;
故选C.
点评 本题考查元素化合物知识,题目难度不大,本题注意把握常见元素化合物的性质.

练习册系列答案
相关题目
1.将下列各种液体:①苯;②四氯化碳;③碘化钾溶液;④乙烯;⑤植物油,分别与溴水混合后充分振荡、静置,液体分为两层,原溴水层几乎是无色的是( )
| A. | ②⑤ | B. | 只有②④ | C. | ①②④⑤ | D. | ①②③④⑤ |
18.下列说法正确的是( )
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol | |
| B. | 500℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g)?2NH2(g)△H=-38.6 kJ•mol | |
| C. | 一定条件下,反应 N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol降低温度将向正反应方向移动 | |
| D. | 已知 2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
5.化学在生产和日常生活中有着重要的应用.下列说法不正确是( )
| A. | 人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 | |
| B. | 严重影响我国北方的霾尘,其颗粒物是种胶体 | |
| C. | 大力实施矿物燃料“脱硫、脱硝技术”,可减少硫的氧化物和氮的氧化物对环境的污染 | |
| D. | 自来水厂常加入FeSO4和Cl2处理水,达到同时杀菌、消毒和聚沉水体中悬浮物的目的 |
15. 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| B. | HB的电离方程式为HB=H++B- | |
| C. | NaA的水溶液中,离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
2.8月12日天津港发生爆炸,专家对爆炸事故原因猜测认为硝化棉或者硫化钠自燃是最可能的点火源,因此化学药品的安全存放是非常重要的.下列有关化学药品的存放说法不正确的是( )
| A. | 液溴易挥发,应用水液封并放在冷暗处保存 | |
| B. | 金属钠遇到氧气立即反应,应保存在煤油中或者液体石蜡里 | |
| C. | 硝酸见光易分解,应用棕色广口试剂瓶保存 | |
| D. | 碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存 |
20.下列实验现象描述错误的是( )
| A. | 硫在空气中燃烧,产生蓝紫色火焰 | |
| B. | 将二氧化碳通入水中,无明显现象 | |
| C. | 红亮的铜丝在酒精灯火焰上灼烧,铜丝表面变黑 | |
| D. | 一氧化碳通过灼热的氧化铁,红色固体变黑 |