题目内容
【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下:

已知:①镓在元素周期表中位于第四周期第ⅢA,化学性质与铝相似。
②lg2=0.3,lg3=0.48。
③部分物质的Ksp如F表所示
物质 |
|
|
|
|
Ksp |
|
|
|
|
(1)滤渣1的主要成分是_________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)___________。
(3)调pH的目的是______;室温条件下,若浸出液中各阳离子的浓度均为0.01 mol/L,当溶液中某种离子浓度小于![]() mol/L时即认为该离子已完全除去,则pH应调节的范围为_______。
mol/L时即认为该离子已完全除去,则pH应调节的范围为_______。
(4)操作D包括:__________过滤、洗涤、干燥。
(5)制备、精炼金属Ga。
①电解法制备金属镓。用惰性电极电解![]() 溶液即可制得金属镓,写出阴极电极反应式_________。
溶液即可制得金属镓,写出阴极电极反应式_________。
②电解法精炼金属镓(粗镓含Zn、Fe、Cu等杂质,已知氧化性:![]()
下列有关电解精炼金属镓的说法正确的是_______(填字母序号)。
A .电解精炼镓时粗镓与电源的正极相连
B. 电解精炼过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,Cu和Fe沉积在电解槽底部形成阳极泥
D. 若用甲烷燃料电池电解精炼金属镓,当阴极有56.0 g镓析出时,电池负极最多消耗标准状况下的![]() 6.72 L
6.72 L
【答案】![]()
![]()
![]() 使
使![]() 、
、![]() 沉淀完全面
沉淀完全面![]() 不沉淀 5.48<pH<6.6 蒸发浓缩,冷却结晶
不沉淀 5.48<pH<6.6 蒸发浓缩,冷却结晶 ![]() AC
AC
【解析】
Ga的性质与Al相似,锌矿渣中加入H2SO4,充分反应,其中Zn、Fe、Ga转化为可溶于水的ZnSO4、FeSO4、Ga2(SO4)3,Pb转化成难溶于水的PbSO4,SiO2与H2SO4不反应,经过滤得到的滤渣1中成分为PbSO4、SiO2; 向浸出液中加入H2O2,H2O2将Fe2+氧化成Fe3+,然后调节溶液的pH使Fe3+、Ga3+转化为氢氧化物沉淀与Zn2+分离;滤渣2的成分为Fe(OH)3和Ga(OH)3,根据图示应向滤渣2中加入NaOH使Ga(OH)3溶解转化为NaGaO2。据此解答。
(1)根据上述分析,滤渣1的成分为SiO2、PbSO4;
(2)Fe2+具有还原性,H2O2将Fe2+氧化成Fe3+,反应的方程式是:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据流程中物质转化关系可知调pH的目的是将Fe3+、Ga3+转化为氢氧化物沉淀,Zn2+不能形成Zn(OH)2,从而与Zn2+分离;Fe(OH)3和Ga(OH)3属于同种类型,![]() >Ksp[
>Ksp[![]() ],Ga3+完全沉淀时Fe3+已经完全沉淀,浓度小于
],Ga3+完全沉淀时Fe3+已经完全沉淀,浓度小于![]() mol/L,c(OH-)=
mol/L,c(OH-)= =
=![]() =
=![]() mol/L,c(H+)=
mol/L,c(H+)=![]() mol/L,pH=-lg
mol/L,pH=-lg![]() =5.48,Zn2+开始沉淀时c(OH-) =
=5.48,Zn2+开始沉淀时c(OH-) = =
=![]() =
=![]() mol/L,c(H+)=
mol/L,c(H+)=![]() mol/L,pH=-lg
mol/L,pH=-lg![]() =6.6,则pH应调节的范围为5.48<pH<6.6
=6.6,则pH应调节的范围为5.48<pH<6.6
(4)操作D包括:蒸发浓缩,冷却结晶、过滤、洗涤、干燥等;
(5)①电解NaGaO2溶液生产Ga,Ga元素的化合价由+3价降为0价,GaO2-转化为Ga为还原反应,电解时还原反应在阴极发生,阴极的电极反应式为:![]() ;
;
②电解精炼镓时粗镓与电源的正极相连,离子氧化性顺序为:Zn2+<Ga2+<Fe2+<Cu2+,则金属还原性顺序为Zn>Ga>Fe>Cu,则阳极上Zn、Ga失电子进入电解质溶液,Fe、Cu以金属单质进入电解质溶液,则阳极泥成分是Fe、Cu,阴极上GaO2-得电子发生还原反应生成Ga,电极反应式为![]() ;甲烷燃料电池负极电极反应:CH4+10OH--8e-=CO32-+7H2O,所以
;甲烷燃料电池负极电极反应:CH4+10OH--8e-=CO32-+7H2O,所以
8Ga ~ 3CH4
8×70g 3×22.4L
56g 6.72L
但是电解精炼镓时能量的利用率达不到100%,实际耗电所消耗标准状态下的![]() 大于6.72L。故说法正确的是AC。
大于6.72L。故说法正确的是AC。

【题目】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性.工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:
I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3+2H+.
Ⅱ.部分离子的沉淀pH:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀PH | 5.2 | 7.6 | 2.7 |
完全沉淀PH | 6.4 | 9.6 | 3.7 |
回答下列问题
(1)碱浸步骤中最好选用______________(填字母)
a. NaOH溶液 b.氨水c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式___________________________________
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去________离子,二是促使_________.
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法____________________.
(5)常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式____________________________.
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示.
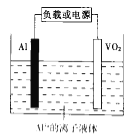
已知放电时电池反应为xAl+VO2=AlxVO2↓,则放电时正极的电极反应式为_____________________.







