题目内容
【题目】硝酸铵常用作化肥和化工原料,工业上制备硝酸铵的简要流程如图:

(1)中和器中主要反应的化学方程式为___________
(2)制备硝酸铵采用加压中和法还是常压中和法?同时说明原因___________
(3)在不同的反应条件下,中和器中硝酸浓度与硝酸铵含量存在如图关系:
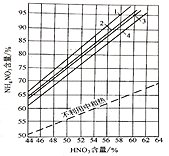
[不利用中和热及在不同情况下利用中和热时生产硝铵溶液中NH4NO3的含量1-HNO3和NH3(70℃);2-HNO3和NH3(50℃);3-HNO3(50℃)和NH3(20℃);4-HNO3和NH3(20℃)]
①按图中的数据分析,要使中和器中硝酸铵含量达到90%以上,原料最佳温度和硝酸最佳含量是__________
A. 70℃;58%
B. HNO3(50℃),NH3(20℃);56%
C. 50℃;56%
D. 20℃;58%
②中和器中产品检测时,工作人员发现N2浓度明显高于正常空气带入的N2浓度,试用化学方程式表示中和器中生成N2的最有可能的过程____________ 、___________
③以下制备硝酸铵分析不正确的是___________
A. 硝酸铵制备中应利用反应的中和热用于预热原料和浓缩硝酸铵溶液。
B. 采用真空蒸发器有利于获得较高浓度的硝酸铵溶液和较大颗粒的硝酸铵晶体析出。
C. 已知NH3与HNO3的气相反应很不彻底,工艺中应尽量使反应在液相中进行,可将硝酸持续匀速地通入预先装有液氨的中和器中反应。
D.充分回收、重复利用蒸发器的蒸气和冷凝液中的产品,可以降低原料损耗。
【答案】NH3+HNO3=NH4NO3 采用加压中和法。原因是加压可以增大反应的速率和提高产率 A 4HNO3=4NO2+O2+2H2O 6NO2+8NH3=7N2+12H2O BC
【解析】
(1)氨气属于碱性气体、硝酸具有酸性,所以碱性气体氨气和硝酸反应生成硝酸铵;
(2)压强越大化学反应速率越快,且增大压强可以提高产率;
(3)①要使中和器中硝酸铵含量达到90%以上,硝酸的含量越低越好;
②HNO3易分解生成NO2、O2、H2O,NO2、NH3能发生氧化还原反应生成N2。
(1)氨气属于碱性气体、硝酸具有酸性,所以碱性气体氨气和硝酸反应生成硝酸铵,反应方程式为NH3+HNO3=NH4NO3;
(2)压强越大单位体积内活化分子个数越多,则化学反应速率越快,该反应前后气体计量数减小,则增大压强可以提高产率,所以采用加压中和法;
(3)①要使中和器中硝酸铵含量达到90%以上,硝酸的含量越低越好,根据图知,温度为70℃、硝酸含量为58%最好,答案选A;
②HNO3易分解生成NO2、O2、H2O,NO2、NH3能发生氧化还原反应生成N2,发生的反应为4HNO3=4NO2+O2+2H2O、6NO2+8NH3=7N2+12H2O;
③A、中和时放出的热量预热原料能加快化学反应速率,浓缩溶液需要加热,所以硝酸铵制备中应利用反应的中和热用于预热原料和浓缩硝酸铵溶液,从而减少资源浪费,A正确,不符合题意;
B、结晶速率越慢得到的颗粒越大,采用真空蒸发器增大蒸发速率,虽然有利于获得较高浓度的硝酸铵溶液,但得到较小颗粒的硝酸铵晶体析出,B错误,符合题意;
C、将硝酸持续匀速地通入预先装有液氨的中和器中反应,放出的热量会使得液氨气化,会导致氨的转化率降低,不利于硝酸铵的制取,C错误,符合题意;
D、充分回收、重复利用蒸发器的蒸气和冷凝液中的产品,增大原料的利用,从而可以降低原料损耗,D正确,不符合题意;答案为:BC。

 阅读快车系列答案
阅读快车系列答案【题目】I.金属晶体中金属原子主要有三种常见的堆积方式,体心立方堆积、面心立方堆积和六方堆积。
(1)金属铜采用下列________(填字母代号)堆积方式。
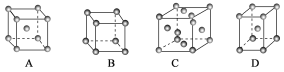
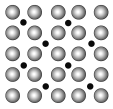
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
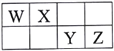
II.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的外围电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1)A和B的离子中,半径较小的是________(填离子符号)。
(2)A、D分别与B形成的化合物中,________的晶格能大(填化学式)。
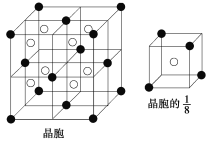
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是____________。A和E化合物的晶胞1/8的体积为2.0×10-23 cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):__________________________________________。