题目内容
【题目】[化学-选修3:物质结构与性质]
铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是 ,铜的基态原子核外电子排布式为 ,元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu比IFe大得多的原因是 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
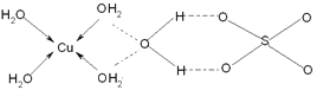
图中虚线表示_____________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
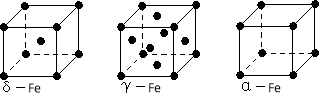
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为 。
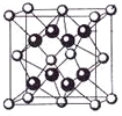
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_______________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为 。
【答案】(1)4周期VIII族,[Ar]3d104s1,铜失去的是全充满的3d10电子,而铁失去的3d6电子;
(2)分子晶体;(3)氢键,正四面体,sp3;![]() ;
;
(4)4:6:3;(5)金属键,Cu3AuH8。
【解析】
试题分析:(1)铁26号元素,位于周期表中第四周期第Ⅷ族,铜位于第四周期第IB族元素,即基态原子核外电子排布式为:[Ar]3d104s1,铁元素基态原子核外电子排布式为:[Ar]3d64s2,铜原子失去一个电子后d能级全充满,而铁原子失去第一个电子后,d能级是3d6,根据洪特规则,全充满、半满、全空电子稳定,因此铜原子的第二电离能大于铁的原子第二电离能;(2)熔点172.5~173℃,100℃以上升华,沸点249℃,这是分子晶体的特点,即二茂铁属于分子晶体;(3)氧原子应形成二个共价键达到8电子稳定结构,因此图中虚线为氢键,SO42-中S有4个σ键,孤电子对数是(6+2-2×4)/2=0,因此价层电子对数为4,空间结构是正四面体,杂化轨道数等于价层电子对数=4,即杂化类型为sp3;O原子价电子是最外层电子,即2s22p4,价电子排布图是:![]() ;(4)第一个晶胞:距离铁原子最近的是对角线上的铁原子,因此最近的有8个,第二个晶胞:最近的面对角线上的铁原子,应有12个,第三个晶胞:最近的有6个,因此比值为8:12:6=4:6:3;(5)两种原子都是金属原子,因此存在的作用力是金属键,根据晶胞的均摊法,Cu位于面心,晶胞中铜原子的个数为6×1/2=3,Au位于顶点,个数为8×1/8=1,Cu和Au构成8个四面体,填充8个氢原子,8个氢原子位于晶胞内部,因此化学式为:Cu3AuH8。
;(4)第一个晶胞:距离铁原子最近的是对角线上的铁原子,因此最近的有8个,第二个晶胞:最近的面对角线上的铁原子,应有12个,第三个晶胞:最近的有6个,因此比值为8:12:6=4:6:3;(5)两种原子都是金属原子,因此存在的作用力是金属键,根据晶胞的均摊法,Cu位于面心,晶胞中铜原子的个数为6×1/2=3,Au位于顶点,个数为8×1/8=1,Cu和Au构成8个四面体,填充8个氢原子,8个氢原子位于晶胞内部,因此化学式为:Cu3AuH8。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案