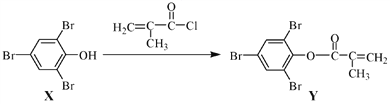
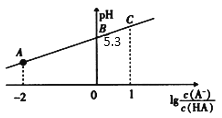
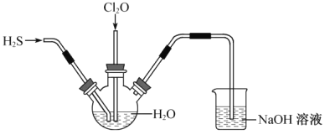
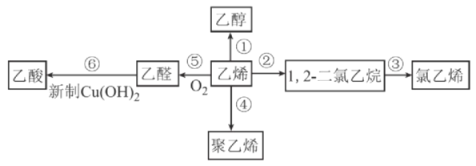
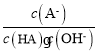题目内容
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,X和Z两元素的原子序数之和等于W元素的原子序数。下列说法正确的是( )
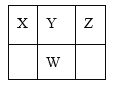
A.X、W分别与Y都能形成两种或两种以上的化合物,这些化合物都是酸性氧化物
B.X、Y、Z都能形成10电子的氢化物,其中Z的最简单氢化物沸点最高
C.X、Y、W与氢四种元素能组成离子化合物,该化合物一定能发生水解
D.X和W两元素的氧化物对应的水化物的酸性:X>W
【答案】C
【解析】
W、X、Y、Z为短周期主族元素,由位置可知X、Y、Z位于第二周期,W位于第三周期,X和Z两元素的原子序数之和等于W元素的原子序数,设Y的原子序数为n,则n-1+n+1=n+8,解得n=8,可知X为N、Y为O、Z为F、W为S,以此来解答。
由分析知:X为N、Y为O、Z为F、W为S;
A.N的氧化物中N2O3和N2O5是酸性氧化物,而NO、NO2等不是酸性氧化物,S的氧化物SO3和SO2均为酸性氧化物,故A错误;
B.N、O、F形成的10电子氢化物是NH3、H2O和HF,其中H2O沸点最高,故B错误;
C.N、O、S与氢四种元素组成的离子化合物是NH4HSO4、NH4HSO3、(NH4)2SO4和(NH4)2SO3等,其中NH4+和SO32-在水溶液中均发生水解,故C正确;
D.N和S的最高价氧化物的水化物的酸性是H2SO4>HNO3,而H2SO3的酸性小于HNO3,故D错误;
故答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.若升高温度,W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是 K= ![]()